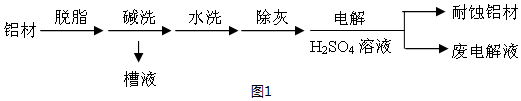
题目内容
19.下列除去杂质(括号内的物质为杂质)的方法中错误的是( )| A. | FeSO4 (CuSO4):加足量铁粉后,过滤 | |
| B. | CO (CO2):用NaOH溶液洗气后干燥 | |
| C. | CO2 (HCl):用NaOH溶液洗气后干燥 | |
| D. | MnO2 (KCl):加水溶解后,过滤、洗涤、烘干 |
分析 A.Fe与硫酸铜反应生成硫酸亚铁和Cu;
B.二氧化碳与NaOH反应,而CO不能;
C.二者均与NaOH反应;
D.KCl溶于水,而MnO2不溶于水.
解答 解:A.Fe与硫酸铜反应生成硫酸亚铁和Cu,反应后过滤可除杂,故A正确;
B.二氧化碳与NaOH反应,而CO不能,则洗气可分离,故B正确;
C.二者均与NaOH反应,不能除杂,应选饱和碳酸氢钠溶液、洗气,故C错误;
D.KCl溶于水,而MnO2不溶于水,则溶解、过滤、洗涤、烘干可分离,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某原子的摩尔质量是Mg•mol-1,则一个该原子的真实质量是( )
| A. | $\frac{M}{6.02×1{0}^{23}}$g | B. | $\frac{1}{M}$ g | C. | M g | D. | $\frac{6.02×1{0}^{23}}{M}$ g |
10.下列说法正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氧化钠是强电解质,醋酸是弱电解质 | |
| C. | 氨气是弱电解质,铜是强电解质 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
7.在如图所示的装置中,a的金属活动性比氢强,b为碳棒,关于此装置的各种叙述不正确的是( )

| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电子从a极流向b极 | |
| D. | a极上发生了氧化反应 |
14.一种微生物燃料电池的结构示意图如图所示,关于该电池的叙述不正确的是( )

| A. | 电池工作时,电子由b流向a | |
| B. | 正极反应式为:MnO2+4H++2e-═Mn2++2H2O | |
| C. | 放电过程中,H+从负极区移向正极区 | |
| D. | 微生物所在电极区放电时发生还原反应 |
4.将某一元弱酸(HA)和氢氧化钠溶液混合,所得溶液呈中性,则此溶液中c(Na+)与c(A-)的大小关系为( )
| A. | c(Na+)=c(A-) | B. | c(Na+)<c(A-) | C. | c(Na+)>c(A-) | D. | 无法确定 |
11.室温下,某溶液中由水电离出的H+和OH-物质的量浓度乘积为1×10-24,该溶液中一定不能大量共存的是
( )
( )
| A. | AlO2- | B. | Fe3+ | C. | HCO3- | D. | NH4+ |