题目内容
18.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | 中性溶液中:Cl-、Mg2+、Al3+、K+ | |
| B. | 1.0mol•L-1的NaAlO2溶液中:Cl-、HCO3-、K+、Ca2+ | |
| C. | 在强碱性环境中:AlO2-、SiO32-、Na+、K+ | |
| D. | 0.1mol•L-1明矾溶液中:NH4+、AlO2-、HCO3-、Na+ |
分析 A.Mg2+、Al3+水解显酸性;
B.AlO2-促进HCO3-的电离;
C.强碱性环境,含大量的氢氧根离子,该组离子之间不反应;
D.AlO2-促进HCO3-的电离,且AlO2-、Al3+相互促进水解.
解答 解:A.Mg2+、Al3+水解显酸性,无水解显碱性的离子,中性溶液不能大量存在,可大量共存,故A错误;
B.AlO2-促进HCO3-的电离生成沉淀,不能大量共存,故B错误;
C.强碱性环境,含大量的氢氧根离子,该组离子之间不反应,可大量共存,故C正确;
D.AlO2-促进HCO3-的电离,且AlO2-、Al3+相互促进水解,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意水解反应及选项B为解答的易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.对常温下pH=3的 CH3COOH溶液,下列叙述不正确的是( )
| A. | c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 加入少量CH3COONa固体后,c(CH3COO-)降低 | |
| C. | 该溶液中由水电离出的 c(H+)是 1.0×10-11mol/L | |
| D. | 与等体积pH=11 的NaOH 溶液混合后所得溶液显酸性 |
6.[Co(NH3)5Cl]Cl2是一种紫红色的晶体,下列说法中正确的是( )
| A. | 配位体是Cl-和NH3,配位数是8 | |
| B. | 中心离子是Co2+,配离子是Cl- | |
| C. | 内界和外界中的Cl的数目比是1:2 | |
| D. | 加入足量AgNO3溶液,所有Cl-一定被完全沉淀 |
13.下列说法正确的是( )
| A. | 1molH2SO4与1molBa(OH)2完全中和所放出的热量为中和热 | |
| B. | 中和反应都是放热反应,盐类水解反应都是吸热反应 | |
| C. | 在101kPa1mol碳燃烧所放出的热量一定是碳的燃绕热 | |
| D. | 碳与二氧化碳的反应是放热反应,也是化合反应 |
10.某学生对铁与水蒸气反应进行实验探究:
(1)铁粉和水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2.
(2)操作II检验反应生成了氢气,说明水具有氧化性(填“氧化性”或“还原性”).
(3)为检验黑色固体成分,取操作IV得到的黄色溶液于两试管中,分别进行如下实验:
a.向试管1中滴加2滴KSCN溶液,溶液变红色;
b.向试管2中滴加2滴K3[Fe(CN)6]溶液,出现蓝色沉淀.
①实验a的目的是检验黄色溶液中存在Fe3+.
②由实验a、b不能判断黑色固体是磁性氧化铁,依据是操作IV中有少量气体生成,未反应完的铁也可以和盐酸反应生成Fe2+.
③该同学通过计算证实了黑色固体一定不是磁性氧化铁纯净物,n≠1.38m.(用m的表达式表示)
(4)资料表明:铁件与水蒸气反应,在表面生成的磁性氧化铁膜可对铁件起到防护作用.运用图1所示装置对该资料进行验证(已知:用铜片、铁件X、电解液构成原电池;氧化膜有保护时,电压会减小).
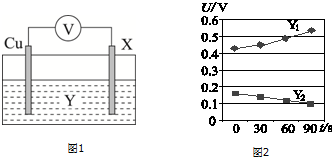
a.当Y为饱和氯化钠时,实验结果如下表:
依据U1<0.91(V),证明该条件下磁性氧化铁膜有保护作用.
b.表面有磁性氧化铁膜但存在少量缺陷的铁片作X,分别用0.1mol/LH2SO4溶液和0.1mol/L CuSO4溶液作Y进行验证实验,得到图2:
①Y2代表的溶液是0.1mol/LCuSO4溶液.
②用离子方程式解释Y1曲线变化的原因:Fe3O4+8H+=Fe2++2Fe3++4H2O..
| 操作 | 现象或结果 |
| I.取m g 铁粉,在水蒸气中加热一段时间 | 灰黑色铁粉变成黑色 |
| II.用排水集气法收集一小试管气体,移近到燃着 的酒精灯火焰 | 发出爆鸣声 |
| III.将黑色固体干燥、称量 | 得到n g 黑色固体 |
| IV.将黑色固体加入到过量的盐酸中 | 固体溶解,有少量气体生成,得到黄色溶液 |
(2)操作II检验反应生成了氢气,说明水具有氧化性(填“氧化性”或“还原性”).
(3)为检验黑色固体成分,取操作IV得到的黄色溶液于两试管中,分别进行如下实验:
a.向试管1中滴加2滴KSCN溶液,溶液变红色;
b.向试管2中滴加2滴K3[Fe(CN)6]溶液,出现蓝色沉淀.
①实验a的目的是检验黄色溶液中存在Fe3+.
②由实验a、b不能判断黑色固体是磁性氧化铁,依据是操作IV中有少量气体生成,未反应完的铁也可以和盐酸反应生成Fe2+.
③该同学通过计算证实了黑色固体一定不是磁性氧化铁纯净物,n≠1.38m.(用m的表达式表示)
(4)资料表明:铁件与水蒸气反应,在表面生成的磁性氧化铁膜可对铁件起到防护作用.运用图1所示装置对该资料进行验证(已知:用铜片、铁件X、电解液构成原电池;氧化膜有保护时,电压会减小).

a.当Y为饱和氯化钠时,实验结果如下表:
| X | U/V |
| 纯铁片 | 0.91 |
| 表面有磁性氧化铁膜的铁片 | U1 |
b.表面有磁性氧化铁膜但存在少量缺陷的铁片作X,分别用0.1mol/LH2SO4溶液和0.1mol/L CuSO4溶液作Y进行验证实验,得到图2:
①Y2代表的溶液是0.1mol/LCuSO4溶液.
②用离子方程式解释Y1曲线变化的原因:Fe3O4+8H+=Fe2++2Fe3++4H2O..
7.某有机物的结构简式为 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 该有机物属于饱和烷烃 | |
| B. | 该烃与2,5-二甲基-3-乙基己烷互为同系物 | |
| C. | 该烃的名称是3-甲基-5-乙基庚烷 | |
| D. | 该烃的一氯取代产物共有8种 |
8.下列描述正确的是( )
| A. | 实验室制取乙酸乙酯的方程式为:CH3COOH+H18O-C2H5$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H${\;}_{2}^{\;}$18O | |
| B. | 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+ | |
| C. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| D. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变 |
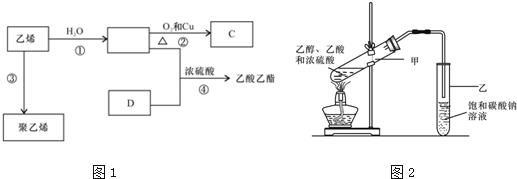
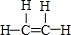 .
. CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.
CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.