题目内容
6.[Co(NH3)5Cl]Cl2是一种紫红色的晶体,下列说法中正确的是( )| A. | 配位体是Cl-和NH3,配位数是8 | |
| B. | 中心离子是Co2+,配离子是Cl- | |
| C. | 内界和外界中的Cl的数目比是1:2 | |
| D. | 加入足量AgNO3溶液,所有Cl-一定被完全沉淀 |
分析 A.围绕中心原子或离子的分子或离子称为配位体(简称配体),其个数为配位数;
B.中心离子电荷数为+3,配离子是Cl-;
C.配合物也叫络合物,由中心原子、配位体和外界组成,内界、外界:内界指配位单元,外界与内界相对;
D.在配合物[Co(NH3)5Cl]Cl2中,有一个氯离子中内界,有两个氯离子在外界,溶液中能与银离子反应生成沉淀的是在外界的氯离子.
解答 解:A.配位数不包括外界离子,[Co(NH3)5Cl]Cl2配位体是Cl-和NH3,配位数是6,故A错误;
B.Co3+为中心离子,电荷数为+3,配离子是Cl-,故B错误;
C.[Co(NH3)5Cl]Cl2内界是[Co(NH3)5Cl]2+,外界是Cl-,内界和外界中的Cl的数目比是1:2,故C正确;
D.Ag++Cl-=AgCl↓,1mol[Co(NH3)5Cl]Cl2电离产生2mol氯离子,加入足量的AgNO3溶液,生成氯化银沉的物质的量是2mol,内界氯离子未沉淀,故D错误;
故选C.
点评 本题考查了配合物的有关知识,明确配合物中內界、外界、配位体、配位数、中心离子的概念是解答关键,特别注意配体和外界离子的区别,题目难度中等.

练习册系列答案
相关题目
16.由苯作原料不能经一步化学反应制得的是( )
| A. | 硝基苯 | B. | 环己烷 | C. | 苯酚 | D. | 溴苯 |
17.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
14.下列有机化合物中均含有杂质,除去这些杂质的方法中正确的是( )
| A. | 苯中含苯酚杂质:加入溴水,过滤 | |
| B. | 乙烷中含乙烯杂质:通入酸性高锰酸钾溶液,洗气 | |
| C. | 乙醇中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 |
1.某种塑料的结构可表示为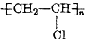 ,合成该塑料所需的原料是( )
,合成该塑料所需的原料是( )
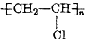 ,合成该塑料所需的原料是( )
,合成该塑料所需的原料是( )| A. | CH3Cl | B. | CH2═CHCl | C. | CH3CH2Cl | D. | CHCl═CHCl |
11.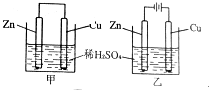 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )
 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )| A. | 甲乙装置中的铜片都作正极 | |
| B. | 甲乙装置中的溶液内的H+均在锌片上被氧化 | |
| C. | 甲乙装置中锌片上发生的反应都是还原反应 | |
| D. | 甲装置中铜片上有气泡生成,乙装置中的铜片质量减小 |
18.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 中性溶液中:Cl-、Mg2+、Al3+、K+ | |
| B. | 1.0mol•L-1的NaAlO2溶液中:Cl-、HCO3-、K+、Ca2+ | |
| C. | 在强碱性环境中:AlO2-、SiO32-、Na+、K+ | |
| D. | 0.1mol•L-1明矾溶液中:NH4+、AlO2-、HCO3-、Na+ |
15.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如图1:

部分含钒物质在水中的溶解性如表:
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)滤液中含钒的主要成分为VOSO4(填化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图2判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,其中n、m分别为2、2.

部分含钒物质在水中的溶解性如表:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)滤液中含钒的主要成分为VOSO4(填化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图2判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,其中n、m分别为2、2.
16.用括号内试剂除去下列各物质中少量杂质,其中不正确的是( )
| A. | 苯中己烯(溴水) | B. | 乙酸乙酯中乙酸(饱和Na2CO3溶液) | ||
| C. | 甲烷中乙烯(溴水) | D. | 苯中苯酚(NaOH溶液) |