题目内容
3.某研究性学习小组设计了一组实验来探究Cl、Br、I元素的原子得电子能力强弱规律.下图中A、B、C是三个可供选择制取氯气的装置,D的玻璃管中①②③④依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球,完成下列问题: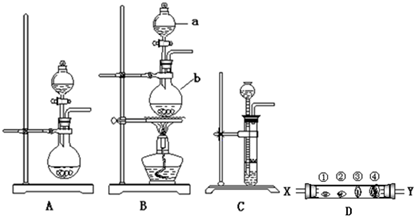
(1)写出装置B中指定仪器b的名称:圆底烧瓶
(2)该小组查阅资料显示实验室制取氯气还可采用下列原理:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
根据该原理需要选择A、B、C装置中的A装置制取氯气.
(3)反应装置的导气管与D装置的X导管(选X或Y),写出D装置中
①处棉球的离子反应方程式:C12+2Br-=2Cl-+Br2;
②处棉球的现象:棉球变蓝;
③处棉球的离子反应方程式:Cl2+2OH-=Cl-+ClO-+H2O;
(4)D装置中④的作用:观察氯气是否被吸收完全.
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子得电子能力依次减弱,你认为上述实验现象能证明上述结论吗?说明理由.不能,由于不能保证氯气和溴化钠完全反应,则生成的溴单质中含有过量的氯气,则不能证明Br和I得电子能力相对强弱.
分析 实验室制备氯气可用二氧化锰和浓盐酸在加热条件下反应,也可用高锰酸钾与浓盐酸反应制备,反应较为剧烈,无需加热即可进行,氯气具有强氧化性,能与NaBr溶液、碘化钾溶液发生置换反应生成单质Br2、I2,氯气在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,氯气与水反应生成HClO,具有漂白性,能使品红褪色,以此解答该题.
(1)依据装置图中仪器形状和应用写出仪器名称;
(2)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应是固体和液体不加热制备气体,据此选择发生装置;
(3)D的玻璃管中①②③④依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球,
①氯气与NaBr溶液反应生成Br2;
②与碘化钾溶液反应生成I2;
③氯气在碱性溶液中自身发生氧化还原反应生成氯化钠、次氯酸钠和水;
(4)氯气与水反应生成HClO,具有漂白性,能使品红褪色;
(5)由于不能保证氯气和溴化钠完全反应,则生成的溴单质中含有过量的氯气.
解答 解:(1)b为圆底烧瓶,故答案为:圆底烧瓶;
(2)高锰酸钾与浓盐酸反应较为剧烈,无需加热即可进行,是固体和液体不加热制备气体装置,选择A,故答案为:A;
(3)检验氯气的性质时,不能先通过NaOH溶液,否则会消耗氯气,且起不到尾气吸收的作用,应从X端进气,
①氯气与NaBr溶液反应生成Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,故答案为:C12+2Br-=2Cl-+Br2;
②与碘化钾溶液反应生成I2,反应的离子方程式为Cl2+2I-=2Cl-+I2,棉球变蓝,故答案为:棉球变蓝;
③氯气在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气与水反应生成HClO,具有漂白性,能使品红褪色,把品红放在最后可观察氯气是否被吸收完全,
故答案为:观察氯气是否被吸收完全;
(5)由于不能保证氯气和溴化钠完全反应,则生成的溴单质中含有过量的氯气,则不能证明Br和I得电子能力相对强弱,
故答案为:不能,由于不能保证氯气和溴化钠完全反应,则生成的溴单质中含有过量的氯气,则不能证明Br和I得电子能力相对强弱.
点评 本题考查氯气制备、性质实验的设计、物质性质和反应现象的判断,题目难度中等,注意有关物质的性质以及实验方案的合理性和实用性.

 名校课堂系列答案
名校课堂系列答案| A. | 苯中含苯酚杂质:加入溴水,过滤 | |
| B. | 乙烷中含乙烯杂质:通入酸性高锰酸钾溶液,洗气 | |
| C. | 乙醇中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 |
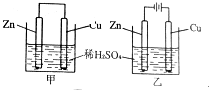 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )| A. | 甲乙装置中的铜片都作正极 | |
| B. | 甲乙装置中的溶液内的H+均在锌片上被氧化 | |
| C. | 甲乙装置中锌片上发生的反应都是还原反应 | |
| D. | 甲装置中铜片上有气泡生成,乙装置中的铜片质量减小 |
| A. | 中性溶液中:Cl-、Mg2+、Al3+、K+ | |
| B. | 1.0mol•L-1的NaAlO2溶液中:Cl-、HCO3-、K+、Ca2+ | |
| C. | 在强碱性环境中:AlO2-、SiO32-、Na+、K+ | |
| D. | 0.1mol•L-1明矾溶液中:NH4+、AlO2-、HCO3-、Na+ |
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH浓溶液,加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 溶液X中有NH4+ |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成红色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 常温下,将铜放入浓硫酸中 | 无明显变化 | 铜在冷的浓硫酸中钝化 |
| A. | A | B. | B | C. | C | D. | D |

部分含钒物质在水中的溶解性如表:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)滤液中含钒的主要成分为VOSO4(填化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图2判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,其中n、m分别为2、2.
| A. | 原子最外层电子数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |

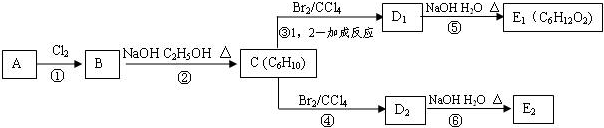
 ;E2含有的含氧官能团的名称为:羟基.
;E2含有的含氧官能团的名称为:羟基.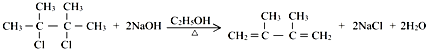 ,反应类型为:消去反应;反应⑥的化学方程式为:
,反应类型为:消去反应;反应⑥的化学方程式为: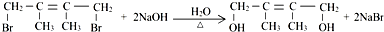 ,反应类型为:水解反应(或取代反应).
,反应类型为:水解反应(或取代反应).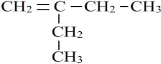 、
、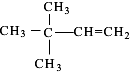 (均不考虑立体异构).
(均不考虑立体异构).