题目内容
9.对常温下pH=3的 CH3COOH溶液,下列叙述不正确的是( )| A. | c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 加入少量CH3COONa固体后,c(CH3COO-)降低 | |
| C. | 该溶液中由水电离出的 c(H+)是 1.0×10-11mol/L | |
| D. | 与等体积pH=11 的NaOH 溶液混合后所得溶液显酸性 |
分析 A.根据醋酸溶液中的电荷守恒判断;
B.加入醋酸钠后,溶液中醋酸根离子浓度增大;
C.醋酸电离出的氢离子抑制了水的电离,醋酸溶液中的氢氧根离子是水电离的;
D.醋酸为弱酸,混合液中醋酸过量,溶液呈酸性.
解答 解:A.根据醋酸溶液中的电荷守恒可得:c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.加入少量CH3COONa固体后,醋酸钠电离出醋酸根离子,则溶液中c(CH3COO-)增大,故B错误;
C.醋酸抑制了水的电离,该溶液中由水电离出的 c(H+)与溶液中氢氧根离子浓度相等,都是 1.0×10-11mol/L,故C正确;
D.醋酸为弱电解质,醋酸的浓度大于氢氧化钠,两溶液等体积混合后醋酸过量,混合液显示酸性,故D正确;
故选B.
点评 本题考查了弱电解质电离平衡及其影响,题目难度中等,涉及酸碱混合定性判断、离子浓度大小比较、弱电解质的电离平衡等知识,明确电离平衡及其影响为解答关键,D为易错点,注意混合液中醋酸过量.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
19.下列叙述中错误的是( )
| A. | 还原性:Na>Mg>Al>Fe | B. | 碱性:NaOH>KOH>Ca(OH)2 | ||
| C. | 稳定性:HF>HCl>HBr>HI | D. | 酸性:HClO4>H2SO4>CH3COOH>H2CO3 |
17.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
4.下列物质中,既能和盐酸反应,又能和氢氧化钠反应的化合物是( )
| A. | 碳酸钠 | B. | 碳酸氢钠 | C. | 铝箔 | D. | 磁性氧化铁 |
14.下列有机化合物中均含有杂质,除去这些杂质的方法中正确的是( )
| A. | 苯中含苯酚杂质:加入溴水,过滤 | |
| B. | 乙烷中含乙烯杂质:通入酸性高锰酸钾溶液,洗气 | |
| C. | 乙醇中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 |
1.某种塑料的结构可表示为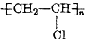 ,合成该塑料所需的原料是( )
,合成该塑料所需的原料是( )
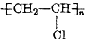 ,合成该塑料所需的原料是( )
,合成该塑料所需的原料是( )| A. | CH3Cl | B. | CH2═CHCl | C. | CH3CH2Cl | D. | CHCl═CHCl |
18.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 中性溶液中:Cl-、Mg2+、Al3+、K+ | |
| B. | 1.0mol•L-1的NaAlO2溶液中:Cl-、HCO3-、K+、Ca2+ | |
| C. | 在强碱性环境中:AlO2-、SiO32-、Na+、K+ | |
| D. | 0.1mol•L-1明矾溶液中:NH4+、AlO2-、HCO3-、Na+ |
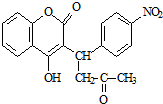 ,醋硝香豆素可以通过以下方法合成(部分反应条件省略).
,醋硝香豆素可以通过以下方法合成(部分反应条件省略).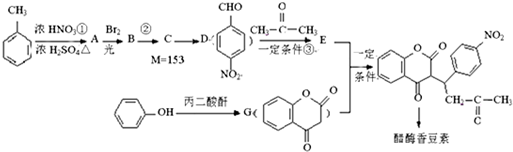
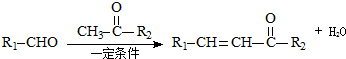
 ;反应②的反应类型水解反应或取代反应.
;反应②的反应类型水解反应或取代反应.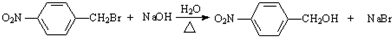 .
.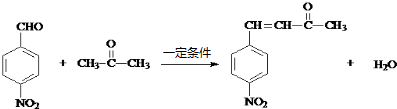 .
. .
. 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: