题目内容
9.X、Y、Z、W是短周期主族元素,X原子最外层电子数是其内层电子数的3倍;Y的原子序数是其最外层电子数的6倍;Z的一种单质是自然界中最硬的物质;自然界中,W的单质多出现在火山口附近,且为淡黄色晶体.下列叙述正确的是( )| A. | 原子半径的大小:Z>X>Y | |
| B. | Z的氢化物的沸点一定比X 的低 | |
| C. | W的最高价氧化物对应水化物的酸性在同主族中最强 | |
| D. | Y的单质与Z、X形成的化合物反应可冶炼金属 |
分析 X、Y、Z、W是短周期主族元素,X原子最外层电子数是其内层电子数的3倍,X为O元素;Y的原子序数是其最外层电子数的6倍,则Y的最外层电子数为2,原子序数为12,即Y为Mg元素;Z的一种单质是自然界中最硬的物质,Z为C元素;自然界中,W的单质多出现在火山口附近,且为淡黄色晶体,W为S,以此来解答.
解答 解:由上述分析可知,X为O,Y为Mg,Z为C,W为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径的大小:Y>Z>X,故A错误;
B.Z的氢化物可能为固态烃,其的沸点可能比X 的高,故B错误;
C.W的最高价氧化物对应水化物为硫酸,其酸性在同主族中最强,故C正确;
D.Y的单质与Z、X形成的化合物反应生成MgO和C,不能冶炼金属,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
20.工业上通过2Al2O3+3C+6Cl2$\frac{\underline{\;高温\;}}{\;}$4AlCl3+3CO2制取无水氯化铝,下列说法正确的是( )
| A. | AlCl3是氧化产物 | B. | 每生成1molCO2,转移2mol电子 | ||
| C. | Cl2是氧化剂 | D. | C发生还原反应 |
4.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 在沸水中滴入含0.1molFeC13的饱和溶液,制得胶粒数为0.1 NA | |
| B. | 含0.4mol HNO3的稀硝酸与足量Fe反应,转移电子数为1.2 NA | |
| C. | 120 gNaHSO4和MgSO4的晶体混合物中阳离子数为NA | |
| D. | 标准状况下,44.8LSO2与足量O2反应生成的SO3分子数为2NA |
1.高铁电池是以高铁酸盐(K2FeO4)和锌为电极材料,具有能量密度大、体积小、重量轻、寿命长、无污染等优点,除比亚迪外目前还没有其他厂家宣称其产品可以大规模实用化.电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
| A. | 充电时阳极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4发生反应,转移电子数约为1.806×1024 | |
| C. | 充电时K2FeO4发生氧化反应 | |
| D. | 放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
18.化学与生活密切相关,下列说法错误的是( )
| A. | 冬季烧煤炭供热取暖与雾霾的形成无必然联系 | |
| B. | 食品包装袋中充人氮气可防腐 | |
| C. | 钢铁表面镀锌可防止铁的腐蚀 | |
| D. | 回收地沟油制造生物柴油符合环境保护的要求 |
10.某有机物的结构简式为HOOC-CH=CH-CH2OH,关于该有机物下列说法错误的是( )
| A. | 该物质有三种官能团,该物质自身能发生酯化反应 | |
| B. | 该物质能使酸性高锰酸钾溶液和溴水褪色,它们的反应原理相同 | |
| C. | 该物质能通过两种方式的反应生成两种高分子物质 | |
| D. | 1mol该物质能够消耗2mol金属钠同时放出1mol氢气 |
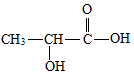 乳酸是世界上公认的三大有机酸之一,其应用非常广泛,可用作食品酸味剂、医药防腐剂、工业pH调节剂等.乳酸的结构简式如图所示.
乳酸是世界上公认的三大有机酸之一,其应用非常广泛,可用作食品酸味剂、医药防腐剂、工业pH调节剂等.乳酸的结构简式如图所示.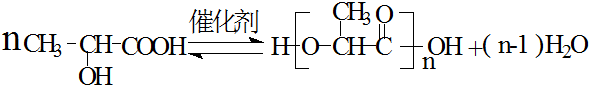 .
.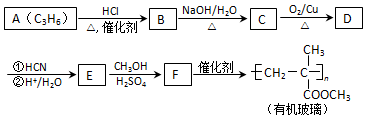
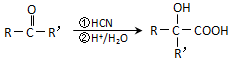 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)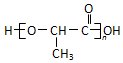 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线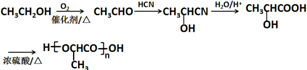 .(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)
.(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)