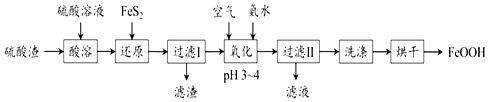
题目内容
18.化学与生活密切相关,下列说法错误的是( )| A. | 冬季烧煤炭供热取暖与雾霾的形成无必然联系 | |
| B. | 食品包装袋中充人氮气可防腐 | |
| C. | 钢铁表面镀锌可防止铁的腐蚀 | |
| D. | 回收地沟油制造生物柴油符合环境保护的要求 |
分析 A.冬季烧煤炭供热,可产生大量颗粒污染物;
B.氮气可隔绝氧气;
C.可隔绝铁与氧气的接触;
D.回收地沟油,可减少垃圾污染.
解答 解:A.冬季烧煤炭供热,可产生大量颗粒污染物,与产生雾霾有关,故A错误;
B.氮气可隔绝氧气,可防止食品变质,故B正确;
C.可隔绝铁与氧气的接触,可起到保护铁的作用,故C正确;
D.回收地沟油,可减少垃圾污染,用于制造生物柴油,可使资源充分利用,故D正确.
故选A.
点评 本题考查较为综合,侧重考查化学与生活、生产和环境,有利于培养学生良好的科学素养,提高学生的积极性,难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
9.X、Y、Z、W是短周期主族元素,X原子最外层电子数是其内层电子数的3倍;Y的原子序数是其最外层电子数的6倍;Z的一种单质是自然界中最硬的物质;自然界中,W的单质多出现在火山口附近,且为淡黄色晶体.下列叙述正确的是( )
| A. | 原子半径的大小:Z>X>Y | |
| B. | Z的氢化物的沸点一定比X 的低 | |
| C. | W的最高价氧化物对应水化物的酸性在同主族中最强 | |
| D. | Y的单质与Z、X形成的化合物反应可冶炼金属 |
13.实验测得pH=1.0的某溶液中还可能大量存在:Na+、Fe2+、Al3+、NH4+、SO42-、Cl-中的若干种离子,现进行了如下实验:
步骤I,取该溶液10.0mL,加入过量1.0mol/L Ba(NO3)2溶液,产生白色沉淀A和无色气体B,B遇空气立即变为红棕色;
步骤Ⅱ.向I所得的溶液中加入过量1.0mol/L NaOH溶液,有红褐色沉淀C和无色刺激性气体D生成.用铂丝蘸取所得溶液,在火焰上灼烧,火焰呈黄色;
步骤Ⅲ.向Ⅱ所得的溶液中通入过量CO2有沉淀E生成.
下列推断错误的是( )
步骤I,取该溶液10.0mL,加入过量1.0mol/L Ba(NO3)2溶液,产生白色沉淀A和无色气体B,B遇空气立即变为红棕色;
步骤Ⅱ.向I所得的溶液中加入过量1.0mol/L NaOH溶液,有红褐色沉淀C和无色刺激性气体D生成.用铂丝蘸取所得溶液,在火焰上灼烧,火焰呈黄色;
步骤Ⅲ.向Ⅱ所得的溶液中通入过量CO2有沉淀E生成.
下列推断错误的是( )
| A. | 步骤I中白色沉淀A的化学式为BaSO4 | |
| B. | 步骤Ⅱ中产生沉淀C的反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 原溶液一定含有:Na+、Fe2+、Al3+、SO42- | |
| D. | CO2先后分别与NaOH(aq)、NaAlO2( aq)反应 |
3.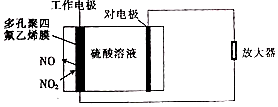 环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
 环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )| A. | “对电极”是负极 | |
| B. | “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O | |
| C. | 传感器工作时H+由工作电极移向对电极 | |
| D. | 对电极的材料可能为活泼金属锌 |
1.在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g)△H,所得实验数据如下表.
(1)实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,v(N)=0.001mol/(L•min);
(2)实验②中,该反应的平衡常数K=1;
(3)实验③中,此时化学反应速率是v(正)<v(逆)(填“=”、“>”或“<”);
(4)反应热△H<0(填“>”或“<”);
(5)应用化学反应速率与化学平衡原理解决化工生产实际问题,你认为下列说法不正确的是c(填字母序号).
a.化学反应速率理论可以指导怎样在一定时间内快出产品
b.勒夏特列原理可以指导怎样使有限原料多出产品
c.催化剂的使用是提高产品产率的有效办法
d.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
(2)实验②中,该反应的平衡常数K=1;
(3)实验③中,此时化学反应速率是v(正)<v(逆)(填“=”、“>”或“<”);
(4)反应热△H<0(填“>”或“<”);
(5)应用化学反应速率与化学平衡原理解决化工生产实际问题,你认为下列说法不正确的是c(填字母序号).
a.化学反应速率理论可以指导怎样在一定时间内快出产品
b.勒夏特列原理可以指导怎样使有限原料多出产品
c.催化剂的使用是提高产品产率的有效办法
d.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
19.表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的是( )
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | C元素的原子最外层电子数等于电子层数 |