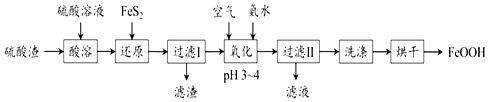
题目内容
14.磷能形成多种含氧酸.(1)次磷酸(H3PO2)是一种精细化工产品,向10mL H3PO2溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子.
①写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式:NaH2PO2,该正盐溶液中各离子浓度由大到小的顺序为c(Na+)>c(H2PO2-)>c(OH-)>c(H+).
②若25℃时,Ka(H3PO2)=1×10-2,则0.01mol•L-1的H3PO2溶液的pH=2.
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1=1×10-2、K2=2.6×10-7.
①试从电离平衡移动的角度解释K1、K2数据的差异H3PO3第一步电离出的H+对第二步电离起到抑制作用.
②NaH2PO3溶液显酸性(填“酸”“碱”或“中”).
( 3 ) 25℃时,HF的电离常数为K=3.6×10-4; H3PO4的电离常数为K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13.足量NaF溶液和H3PO4溶液反应的离子方程式为F-+H3PO4=HF+H2PO4-.
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中.c(H+)由大到小的顺序为H3PO3>H3PO2>H3PO4(用酸的分子式表示).
分析 (1)①向10mL H3PO2溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子,说明H3PO2是一元酸,H3PO2溶液与足量NaOH 溶液反应后形成的正盐为NaH2PO2;
该酸为弱酸,酸根离子水解导致溶液呈碱性,但其水解程度较小;
②该溶液中c(H+)=$\sqrt{Ka.c({H}_{3}P{O}_{2})}$,pH=-lgc(H+);
(2)①第一步电离出的氢离子抑制第二步电离;
②NaH2PO3是强碱弱酸盐酸式盐,该酸根离子电离程度大于其水解程度;
(3)HF的电离平衡常数小于磷酸的第一步电离平衡常数大于其第二步、第三步电离平衡常数,所以NaF和磷酸反应生成HF和磷酸二氢钠;
(4)相同浓度的这三种含磷的酸中,其电离平衡常数越大,氢离子浓度越大.
解答 解:(1)①向10mL H3PO2溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子,说明H3PO2是一元酸,H3PO2溶液与足量NaOH 溶液反应后形成的正盐为NaH2PO2;
该酸为弱酸,酸根离子水解导致溶液呈碱性,但其水解程度较小,离子浓度大小顺序是c(Na+)>c(H2PO2-)>c(OH-)>c(H+),
故答案为:NaH2PO2;c(Na+)>c(H2PO2-)>c(OH-)>c(H+);
②该溶液中c(H+)=$\sqrt{Ka.c({H}_{3}P{O}_{2})}$,pH=-lgc(H+)=-lg$\sqrt{1×1{0}^{-2}×0.01}$=2,
故答案为:2;
(2)①第一步电离出的氢离子抑制第二步电离,所以第一步电离平衡常数与第二步电离平衡常数相差较大,
故答案为:H3PO3第一步电离出的H+对第二步电离起到抑制作用;
②亚磷酸(H3PO3)是二元中强酸,NaH2PO3是强碱弱酸盐酸式盐,该酸根离子电离程度大于其水解程度,则该NaH2PO3溶液呈酸性,故答案为:酸;
(3)HF的电离平衡常数小于磷酸的第一步电离平衡常数大于其第二步、第三步电离平衡常数,所以NaF和磷酸反应生成HF和磷酸二氢钠,离子方程式为F-+H3PO4=HF+H2PO4-,
故答案为:F-+H3PO4=HF+H2PO4-;
(4)相同浓度的这三种含磷的酸中,其电离平衡常数越大,氢离子浓度越大,电离平衡常数(多元酸看第一步电离平衡常数)H3PO3>H3PO2>H3PO4,则酸性H3PO3>H3PO2>H3PO4,相同浓度的这几种酸中氢离子浓度H3PO3>H3PO2>H3PO4,故答案为:H3PO3>H3PO2>H3PO4.
点评 本题考查弱电解质的电离、离子浓度大小比较等知识点,侧重考查学生分析判断能力,明确弱酸的电离平衡常数与其酸性强弱关系、强酸制取弱酸原理是解本题关键,题目难度不大.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | NH4Cl | B. | Al2(SO4)3 | C. | NaHCO3 | D. | Na2SO4 |
| A. | Fe(NO3)3溶液中加入足量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 用H2O2和H2SO4的混合溶液蚀刻铜:Cu+H2O2+2H+═Cu2++2H2O | |
| C. | NH4HCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | C12通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
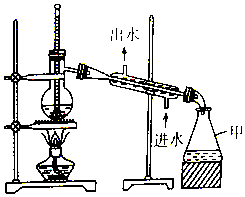
| A. | 仪器甲是锥形瓶,可直接用酒精灯加热 | |
| B. | 温度计水银球应该置于蒸馏烧瓶支管口处 | |
| C. | 直形冷凝管可用球形冷凝管代替 | |
| D. | 石油蒸馏时加沸石,制蒸馏水时不用加沸石 |
| A. | 原子半径的大小:Z>X>Y | |
| B. | Z的氢化物的沸点一定比X 的低 | |
| C. | W的最高价氧化物对应水化物的酸性在同主族中最强 | |
| D. | Y的单质与Z、X形成的化合物反应可冶炼金属 |
| A. | 标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA | |
| B. | 20gH218O中含有的质子数为10NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA |
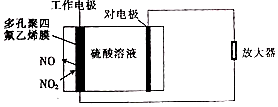 环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )| A. | “对电极”是负极 | |
| B. | “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O | |
| C. | 传感器工作时H+由工作电极移向对电极 | |
| D. | 对电极的材料可能为活泼金属锌 |
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Li>Na>K>Rb>Cs | ||
| C. | 酸性:HClO4>H2SO4>H2SeO4 | D. | 碱性:KOH>Mg(OH)2>Al(OH)3 |