题目内容
10.钠元素在周期表中的位置是( )| A. | 第二周期ⅣA族 | B. | 第三周期IA族 | C. | 第三周期ⅥA族 | D. | 第二周期ⅥA族 |
分析 钠元素原子核外电子排布为1s22s22p63s1,主族元素周期数=电子层数,主族族序数=最外层电子数.
解答 解:钠元素原子核外电子排布为1s22s22p63s1,原子核外有3个电子层,最外层电子数为1,处于周期表中第三周期IA族,故选:B.
点评 本题考查原子结构与位置关系,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.为确定某种抗酸药-碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]的组成,进行如下实验:
Ⅰ、向一定量样品中加入过量盐酸,产生气体A.
Ⅱ、向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅲ、向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅳ、向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
已知:Al3+在pH=5.0时沉淀完全:Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.且有n(A):n(B):n(C)=2:2:3,则该碱式碳酸铝镁的化学式为( )
Ⅰ、向一定量样品中加入过量盐酸,产生气体A.
Ⅱ、向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅲ、向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅳ、向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
已知:Al3+在pH=5.0时沉淀完全:Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.且有n(A):n(B):n(C)=2:2:3,则该碱式碳酸铝镁的化学式为( )
| A. | Mg2Al2(OH)4(CO3)3 | B. | Mg3Al2(OH)6(CO3)2 | C. | Mg3Al(OH)3(CO3)3 | D. | Mg3Al2(OH)8(CO3)2 |
18.工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A. | 反应过程中,若减小压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L•min) | |
| D. | 当反应吸收热量为0.5QkJ时,生成的HCl通入1L 1mol/L的NaOH溶液恰好完全反应 |
15.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 1mol氯气参加氧化还原反应时电子转移数一定是2NA | |
| B. | 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA | |
| C. | 同温同压下,等质量的H2和O2的体积之比是16:1 | |
| D. | 0.1mol/L的MgCl2溶液中Cl-离子数为2NA |
2.下列反应属于氧化还原反应的是( )
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | CaCO3=CaO+CO2↑ | D. | Mg+2HCl=MgCl2+H2↑ |
19.下列叙述正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 铁与硝酸反应后溶液中一定有Fe3+存在 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
20.下列各组中的离子,能再溶液中大量共存的是( )
| A. | H+、Na+、HCO3-、Cl- | B. | K+、Fe2+、Cl-、OH- | ||
| C. | Ag+、Al3+、NO3-、H+ | D. | Fe3+、Al3+、SCN-、Cl- |
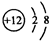 ;O的电子式为
;O的电子式为 ;H2S的结构式为H-S-H.
;H2S的结构式为H-S-H.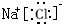 ,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.
,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.