题目内容
7.已知物质A、B、C、D、E、F有如下转化关系:
试根据上述变化,推断A、B、C、D、E、F的可能化学式.
分析 氯化钠转化得到A、B,二者又得到NaCl,则A为Na、B为Cl2,
(1)当C为NaOH时,D可以为FeCl3,E为Na2CO3;F为CaCl2,
(2)当C为NaOH时,D可以为HCl,E为Na2SO4;F为BaCl2,
(3)当C为Na2O2时,D可以为FeCl3,E为Na2CO3;F为BaCl2,
(4)当C为Na2O2时,D可以为HCl,E为NaOH;F为MgCl2.
解答 解:氯化钠转化得到A、B,二者又得到NaCl,则A为Na、B为Cl2,
(1)当C为NaOH时,即Na与水反应生成C,NaOH与二氧化碳反应生成E为Na2CO3,D可以为氯气与铁反应生成的FeCl3,FeCl3与氢氧化钙反应生成F为CaCl2,则C+D、E+F都能生成NaCl;
(2)当C为NaOH时,即Na与水反应生成C,NaOH与硫酸镁反应生成E为Na2SO4,D可以为氯气与氢气反应生成的HCl,HCl与氢氧化钡反应生成F为BaCl2,则C+D、E+F都能生成NaCl;
(3)当C为Na2O2时,即Na与氧气点燃生成C,Na2O2与二氧化碳反应生成E为Na2CO3,D可以为氯气与铁反应生成的FeCl3,FeCl3与氢氧化钡反应生成F为BaCl2,则C+D、E+F都能生成NaCl;
(4)当C为Na2O2时,即Na与氧气点燃生成C,Na2O2与水反应生成E为NaOH,D可以为氯气与氢气反应生成的HCl,HCl与镁反应生成F为MgCl2,则C+D、E+F都能生成NaCl;
答:A、B、C、D、E、F的可能化学式为:
第一组 A:Na;B:Cl2;C:NaOH;D:FeCl3;E:Na2CO3;F:CaCl2.
第二组 A:Na;B:Cl2;C:NaOH;D:HCl;E:Na2SO4;F:BaCl2.
第三组 A:Na;B:Cl2;C:Na2O2;D:HCl;E:NaOH;F:MgCl2.
第四组 A:Na;B:Cl2;C:Na2O2;D:FeCl3;E:Na2CO3;F:BaCl2.
点评 本题考查无机物的推断,为高频考点,把握钠及其化合物的性质、氯气的性质是解答本题的关键,注意物质之间的转化即可解答,题目难度不大.

 阅读快车系列答案
阅读快车系列答案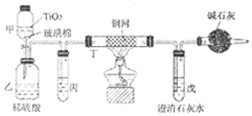
(1)NaCN的电子式为Na+
 .
.(2)甲中反应的化学方程式为NaCN+NaClO=NaCNO+NaCl,乙中反应的离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O、2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
(3)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,丙中加入饱和食盐水,则装置的作用为除去氯气中的氯化氢.
(4)设计一个确定CN-被处理的百分率的实验方案过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入戊装置影响沉淀测定的准确度.
(5)氢氰酸(HCN)是现代最早广泛使用的熏蒸之一,可以用于防治各种仓储害虫.在含有NaCN的废液中通入CO2可以制备氢氰酸.己知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 碘水 | B. | 氯化钠溶液 | C. | 氢氧化钠溶液 | D. | 溴水 |
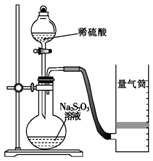 下面是某同学测定化学反应速率并探究其影响因素的实验.
下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化等(写一种).
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如表.(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
| A. | 按系统命名法,化合物 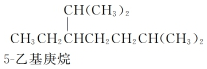 的名称为2,6二甲基5乙基庚烷 的名称为2,6二甲基5乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 化合物  是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
| A. | FeS2 | B. | CaC2 | C. | BaO2 | D. | MgCl2 |
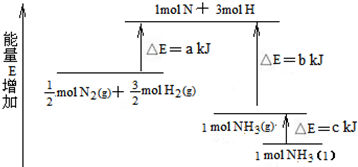
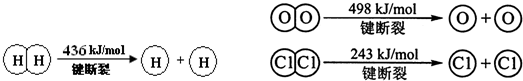
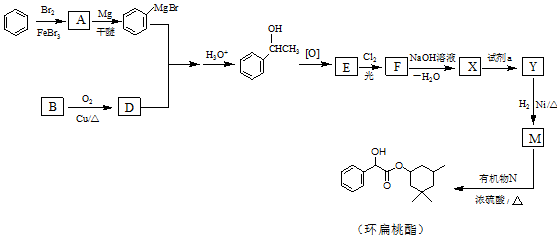
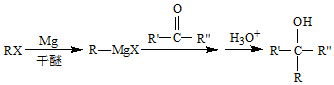 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)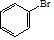 .
.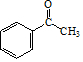 .
.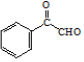 .
.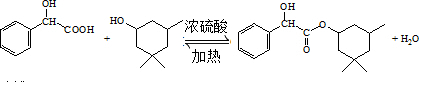 .
.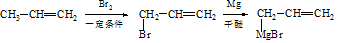
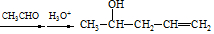
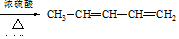 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).