题目内容
11.氨的合成对国家工业发展有着举足轻重的作用,请根据化学原理知识回答下列问题:(1)已知氢气的燃烧热为285.8kJ/mol.
4NH3 (g)+5O2 (g)?4NO(g)+6H2O(l)△H=-1168.8kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则工业合成氨的热化学方程式为N2(g)+3H2(g)═2NH 3 (g)△H=-92.4kJ/mol.
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.实验结果如图1所示:(图中 T表示温度,n表示物质的量)
①图象中 T2和 T1的关系是:T2高于 T1(填“高于”、“低于”、“等于”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是c(填字母).
③在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下( T 2),反应的平衡常数 K=$\frac{25}{12}$.
(3)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2?N2O4△H<0,将一定量的NO2充入注射器中后封口,图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小).下列说法正确的是AC
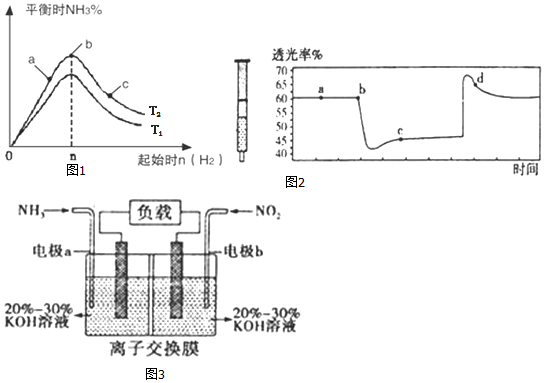
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)>v(逆)
(4)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图3所示.
①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有0.1mol NO2被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.
分析 (1)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②4NH 3 (g)+5O 2 (g)?4NO(g)+6H 2O(l)△H=-1168.8kJ/mol,
③N2(g)+O 2(g)═2NO(g)△H=+180.6kJ/mol,
根据盖斯定律,①×3+③-$\frac{1}{2}$×②可得N2(g)+3H2(g)═2NH 3 (g)△H;
(2)①根据温度升高化学平衡向着吸热方向进行;
②根据a、b、c三点所表示的意义,结合化学平衡移动的方向进行判断;
③根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
(3)该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析;
(4)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极;负极失电子发生氧化反应据此书写点击方程式;
②当有0.1mol NO2被处理时,转移电子为0.1mol×(4-0)=0.4mol,据此进行分析;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作.
解答 解:(1)氢气的燃烧热为285.8kJ/mol,可得①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②4NH 3 (g)+5O 2 (g)?4NO(g)+6H 2O(l)△H=-1168.8kJ/mol,
③N2(g)+O 2(g)═2NO(g)△H=+180.6kJ/mol,
根据盖斯定律,①×3+③-$\frac{1}{2}$×②可得N2(g)+3H2(g)═2NH 3 (g)△H=(-285.8kJ/mol)×3+(+180.6kJ/mol)-$\frac{1}{2}$×(-1168.8kJ/mol)=-92.4kJ/mol,
故答案为:N2(g)+3H2(g)═2NH 3 (g)△H=-92.4kJ/mol;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,
故答案为:高于;
②c点氢气的物质的量比ab点多,平衡向右移动,氮气的转化率增大,
故答案为:c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为$\frac{1}{3}$n,当n=3mol反应达到平衡时H2的转化率为60%,故起始氮气浓度为1mol/L,变化的氢气浓度为1.8mol/L,变化的氮气浓度为0.6mol/L,平衡时氮气、氢气、氨气的浓度分别是0.4mol/L、1.2mol/L、1.2mol/L,据K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$=$\frac{1×{2}^{2}}{0.4×1.{2}^{3}}$=$\frac{25}{12}$,
故答案为:$\frac{25}{12}$;
(3)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;
B、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),升温平衡逆向移动,平衡常数减小,所以Kb>Kc,故C正确;
D、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;
故答案为:AC;
(4)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O,
故答案为:负;2NH3-6e-+60H-=N2+6H2O;
②当有0.1mol NO2被处理时,转移电子为0.1mol×(4-0)=0.4mol,
故答案为:0.4;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,
故答案为:阴离子.
点评 本题主要考查的是反应热的计算、化学反应平衡移动与图象、电化学等知识,综合性较强,难度较大,注意氧化还原反应原理在电化学中的应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Mg(OH)2不能转化为Ca(OH)2 | B. | Ca(OH)2的溶解度最小 | ||
| C. | Ca(OH)2不能转化为 Mg(OH)2 | D. | Ksp越大,S不一定越大 |
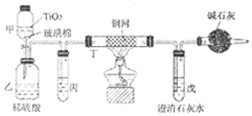
(1)NaCN的电子式为Na+
 .
.(2)甲中反应的化学方程式为NaCN+NaClO=NaCNO+NaCl,乙中反应的离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O、2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
(3)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,丙中加入饱和食盐水,则装置的作用为除去氯气中的氯化氢.
(4)设计一个确定CN-被处理的百分率的实验方案过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入戊装置影响沉淀测定的准确度.
(5)氢氰酸(HCN)是现代最早广泛使用的熏蒸之一,可以用于防治各种仓储害虫.在含有NaCN的废液中通入CO2可以制备氢氰酸.己知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 碘水 | B. | 氯化钠溶液 | C. | 氢氧化钠溶液 | D. | 溴水 |

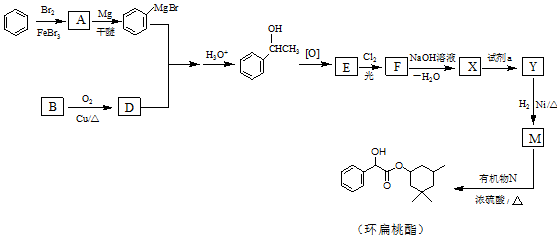
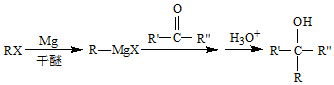 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)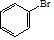 .
.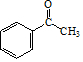 .
.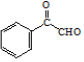 .
.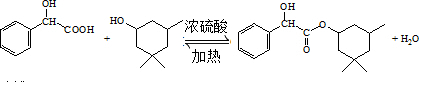 .
.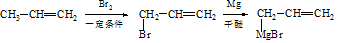
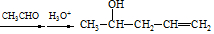
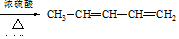 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).