题目内容
8.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,30g丙醇中存在的共价键总数为5NA | |
| C. | 2 mol Cu和足量热浓硫酸反应可生成2NA个SO3分子 | |
| D. | 电解法精炼铜时,若转移的电子数为NA个,则阳极质量减小32g |
分析 A、H218O与D2O的摩尔质量相同,且均为20g/mol;
B、求出丙醇的物质的量,然后根据丙醇中含11条共价键来分析;
C、铜和浓硫酸反应生成二氧化硫分子;
D、电解精炼铜时,阳极上放电的不只是铜.
解答 解:A、H218O与D2O的摩尔质量相同,且均为20g/mol,故2.0g混合物的物质的量为0.1mol,而H218O与D2O中均含有10个中子,故0.1mol混合物中含NA个中子,故A正确;
B、30g丙醇的物质的量为0.5mol,而丙醇中含11条共价键,故0.5mol丙醇中含5.5NA条共价键,故B错误;
C、铜和浓硫酸反应生成二氧化硫分子,而不是三氧化硫分子,故C错误;
D、电解精炼铜时,阳极上放电的不只是铜,还有比铜活泼的金属,故当转移的电子数为NA个时,阳极上质量减少不是32g,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 容量瓶和分液漏斗使用前必须要检漏、干燥 | |
| B. | 可以用酒精萃取溶解在水中的碘 | |
| C. | 新制氯水应保存在棕色细口瓶中 | |
| D. | 某溶液焰色反应呈黄色,说明溶液中含有Na+,不含K+ |
3.氰化物广泛应用于冶金、化工、医药等行业,因其对人畜及环境的巨大危害,需对含氰化物的废液进行深度处理.如处理含有NaCN的废液时,可在催化剂TiO2作用下,先用NaC1O将NaCN 氧化成NaCNO,再在酸性条件下继续被NaClO氧化,生成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性.将含一定量NaCN的污水浓缩后与过量NaClO溶液混合倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.
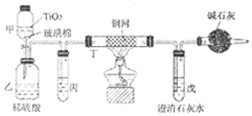
(1)NaCN的电子式为Na+ .
.
(2)甲中反应的化学方程式为NaCN+NaClO=NaCNO+NaCl,乙中反应的离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O、2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
(3)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,丙中加入饱和食盐水,则装置的作用为除去氯气中的氯化氢.
(4)设计一个确定CN-被处理的百分率的实验方案过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入戊装置影响沉淀测定的准确度.
(5)氢氰酸(HCN)是现代最早广泛使用的熏蒸之一,可以用于防治各种仓储害虫.在含有NaCN的废液中通入CO2可以制备氢氰酸.己知:
写出含NaCN的废液通入少量CO2发生反应的化学方程式NaCN+H2O+CO2=HCN+NaHCO3.

(1)NaCN的电子式为Na+
 .
.(2)甲中反应的化学方程式为NaCN+NaClO=NaCNO+NaCl,乙中反应的离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O、2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
(3)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,丙中加入饱和食盐水,则装置的作用为除去氯气中的氯化氢.
(4)设计一个确定CN-被处理的百分率的实验方案过滤、洗涤、干燥、称量戊中沉淀的质量,计算出CN-被处理的百分率,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入戊装置影响沉淀测定的准确度.
(5)氢氰酸(HCN)是现代最早广泛使用的熏蒸之一,可以用于防治各种仓储害虫.在含有NaCN的废液中通入CO2可以制备氢氰酸.己知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
13.下列操作实验操作、现象、解释或结论都正确的是( )
| 操作 | 现象 | 解释或结论 | |
| A | 充分浸透了 Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可用作木材防火剂 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中有Na+、无K+ |
| C | 分别向含有酚酞的烧碱溶液中通入氯气、二氧化硫 | 溶液颜色都变淺 | 说明氯气和二氧化硫都有 漂白性 |
| D | 向某加碘食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加 KIO3 |
| A. | A | B. | B | C. | C | D. | D |
20.可用来鉴别淀粉溶液、苯、乙酸的试剂是( )
| A. | 碘水 | B. | 氯化钠溶液 | C. | 氢氧化钠溶液 | D. | 溴水 |
12.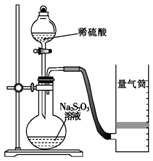 下面是某同学测定化学反应速率并探究其影响因素的实验.
下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化等(写一种).
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如表.(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响,淀粉溶液的作用是作为显色剂,检验I2的存在,表中Vx=4.0 mL,通过比较t1、t2、t3大小,试推测该实验结论:其他条件不变,反应物浓度越大,化学反应速率越大.
 下面是某同学测定化学反应速率并探究其影响因素的实验.
下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化等(写一种).
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如表.(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
13.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 次氯酸分子的结构式: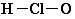 | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: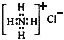 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
