题目内容
20. 如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.
如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.
分析 长颈漏斗用于制备气体时,漏斗下端应插入到试管底部,分液漏斗由球形和梨形两张,球形漏斗可用于制备气体,梨形漏斗用于分液,普通漏斗用于过滤以及加入溶液,结合组合后装置在实验中的应用来分析解答.
解答 解:A与③组合,可用于固体+液体→气体;
B与②④(或①②④)组合,可用于分液或过滤;
C与组合①,可用于制备气体;
D与④组合,便于加入酒精,防止外流;
故答案为:③;②④(或①②④);①;④.
点评 本题考查了常见仪器的作用,为高频考点,侧重于学生的实验能力的考查,题目难度不大,熟悉常见的化学实验仪器,明确其使用是解题的关键.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
15.PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g)△H<0.有关数据如下:
下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 | |
| C. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
5. 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
步骤一:氮气与氢气合成氨气;步骤二:氨气的催化氧化;步骤三:NO的氧化再水化.
请回答下列问题:
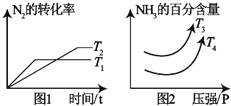
(1)对于N2(g)+3H2(g)═2NH3(g)△H1kJ/mol,满足如图1象:
①根据图△H1<0,T3<T4.(填“>”“<”“=”)
②若温度为T1且容积为2L的密闭容器下中,发生合成氨的反应,起始时通入2mol的N2和6mol的H2,10分钟达到平衡状态,此时NH3的体积分数为60%.则0到10min内用H2表示化学反应速率为0.225mol/(L•min),N2的转化率为75%,反应开始和平衡状态体系的压强之比等于8:5.T1温度下平衡常数K≈21.3,若升高温度K值减小.(填“增大”“减小”“不变”)
③若第②小问中反应体系达到平衡后,再通入1mol N2和3mol H2,则H2转化率增大.(填“增大”“减小”“不变”)
④若恒定温度为T1,容积为2L,则若开始通入2mol N2和2mol H2和2mol的NH3则反应开始时V正>V逆(填“>”“<”“=”),达到新的平衡状态后,再通入2mol N2,则N2的转化率降低.(填“升高”、“降低”或者“不变”)
⑤对于合成氨的体系中,既可以增大反应速率又可以提高H2的转化率的措施有增大压强和增大N2浓度.(填两点即可)
(2)已知:
则△H1=(a+3b-6c)kJ/mol,问题(1)第②小问中能量变化为9c-1.5a-4.5bkJ.
(3)已知:
①N2(g)+3H2(g)═2NH3(g)△H1kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2kJ/mol
③4NO(g)+3O2(g)+2H2O(g)═4HNO3(aq)△H3kJ/mol
则N2(g)+3H2(g)+4O2(g)═2HNO3(aq)+2H2O(l)△H=(△H1+0.5△H2+0.5△H3)kJ/mol(用a、b、c、△H2和△H3表示)
 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:步骤一:氮气与氢气合成氨气;步骤二:氨气的催化氧化;步骤三:NO的氧化再水化.
请回答下列问题:
(1)对于N2(g)+3H2(g)═2NH3(g)△H1kJ/mol,满足如图1象:
①根据图△H1<0,T3<T4.(填“>”“<”“=”)
②若温度为T1且容积为2L的密闭容器下中,发生合成氨的反应,起始时通入2mol的N2和6mol的H2,10分钟达到平衡状态,此时NH3的体积分数为60%.则0到10min内用H2表示化学反应速率为0.225mol/(L•min),N2的转化率为75%,反应开始和平衡状态体系的压强之比等于8:5.T1温度下平衡常数K≈21.3,若升高温度K值减小.(填“增大”“减小”“不变”)
③若第②小问中反应体系达到平衡后,再通入1mol N2和3mol H2,则H2转化率增大.(填“增大”“减小”“不变”)
④若恒定温度为T1,容积为2L,则若开始通入2mol N2和2mol H2和2mol的NH3则反应开始时V正>V逆(填“>”“<”“=”),达到新的平衡状态后,再通入2mol N2,则N2的转化率降低.(填“升高”、“降低”或者“不变”)
⑤对于合成氨的体系中,既可以增大反应速率又可以提高H2的转化率的措施有增大压强和增大N2浓度.(填两点即可)
(2)已知:
| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
(3)已知:
①N2(g)+3H2(g)═2NH3(g)△H1kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2kJ/mol
③4NO(g)+3O2(g)+2H2O(g)═4HNO3(aq)△H3kJ/mol
则N2(g)+3H2(g)+4O2(g)═2HNO3(aq)+2H2O(l)△H=(△H1+0.5△H2+0.5△H3)kJ/mol(用a、b、c、△H2和△H3表示)
10.2A(g)+B(g)?3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
| A. | v(A)=0.7 mol/(L.min) | B. | v(B)=0.3mol/(L.min) | ||
| C. | v(C)=0.9 mol/(L.min) | D. | v(D)=1.1mol/(L.min) |