题目内容
6.已知碘在四氯化碳液体中的溶解度远大于在水中的溶解度,且固体碘在受热时,易直接变成气体,欲把碘从饱和碘水中分离出来,可采用的方法和主要仪器为( )| A. | 蒸发、结晶与蒸发皿 | B. | 过滤与漏斗 | ||
| C. | 萃取、分液与分液漏斗 | D. | 蒸馏与蒸馏装置 |
分析 碘不易溶于水,易溶于四氯化碳,萃取后分液可分离,以此来解答.
解答 解:把碘从饱和碘水中分离出来,利用四氯化碳萃取后,分液可分离,需要的主要仪器为分液漏斗,
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及分离方法为解答的关键,侧重分析与实验能力的考查,注意信息的应用,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案
相关题目
6.设NA为阿伏加德罗常数,以下叙述正确的是( )
| A. | 1 L 0.1 mol/L NH4NO3溶液中含有铵根离子数目为0.1NA | |
| B. | 标准状况下,22.4 L SO3中含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L氯气与含有1 mol FeI2的溶液反应时,转移的电子数为2NA | |
| D. | 常温常压下,16g O2作氧化剂时转移电子数一定为2NA |
7.表为元素周期表中短周期的一部分,其中Y元素的原子序数等于M与N元素原子序数之和.下列说法错误的是( )
| M | N | ||
| X | Y | Z |
| A. | 最简单氢化物的稳定性:M>N>Z | B. | 最高价含氧酸的酸性:Z>M>Y | ||
| C. | 单质的熔点:X>Z>N | D. | 简单离子的半径:Z>N>X |
4.下列做法不正确的是( )
| A. | 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱 | |
| B. | 金属Mg失火时不能用泡沫灭火器扑灭 | |
| C. | 土壤胶粒带负电荷,有利于铵态氮肥的吸收 | |
| D. | 水玻璃可用于生产黏合剂和防火剂 |
11.二氧化氯被国际上公认为安全、无毒的绿色消毒剂,以KClO3溶液为原料,采用电解法生产二氧化氯反应原理如下:4ClO3-+2H2O$\frac{\underline{\;通电\;}}{\;}$4ClO2↑+O2↑+4OH-.下列说法正确的是( )
| A. | 电解过程中OH-向阴极迁移 | |
| B. | 阳极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 毎有l mol电子转移,生成标准状况下5.6L气体 | |
| D. | 电解过程中阴极区溶液的pH降低 |
18.表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | H2CO3 | HClO |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3×10-8 |
| A. | lmolCl2通入足量的水中充分反应,转移的电子数约为6.02×1023 | |
| B. | 将少量CO2气体通入NaClO溶液中的离子方程式:CO2+H2O+ClO-═HCO3-+HC1O | |
| C. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的值不变 | |
| D. | 向浓度均为1×103 mol/L-1的KC1和K2CrO4混合溶液中滴加1×10-3 mol/L-1的AgNO3溶液Cl-先沉淀 |
16.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
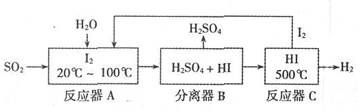
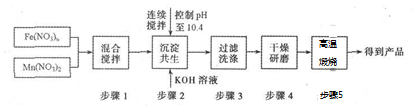
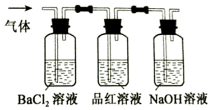 FeSO4受热分解的化学方程式为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑
FeSO4受热分解的化学方程式为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑