题目内容
11.二氧化氯被国际上公认为安全、无毒的绿色消毒剂,以KClO3溶液为原料,采用电解法生产二氧化氯反应原理如下:4ClO3-+2H2O$\frac{\underline{\;通电\;}}{\;}$4ClO2↑+O2↑+4OH-.下列说法正确的是( )| A. | 电解过程中OH-向阴极迁移 | |
| B. | 阳极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 毎有l mol电子转移,生成标准状况下5.6L气体 | |
| D. | 电解过程中阴极区溶液的pH降低 |
分析 A.电解池中阴离子移向阳极;
B.阳极氢氧根离子失去电子发生氧化反应;
C.依据方程式4ClO3-+2H2O$\frac{\underline{\;通电\;}}{\;}$4ClO2↑+O2↑+4OH-.转移1mol电子生成0.25mol氧气和1mol二氧化氯;
D.阴极氯酸根离子得到电子结合氢离子生成二氧化氯和水.
解答 解:A.氢氧根离子为阴离子,电解过程移向阳极,故A错误;
B.阳极氢氧根离子失去电子发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O,故B正确;
C.依据方程式4ClO3-+2H2O$\frac{\underline{\;通电\;}}{\;}$4ClO2↑+O2↑+4OH-.转移1mol电子生成0.25mol氧气和1mol二氧化氯,生成气体标况下体积28L,故C错误;
D.阴极电极反应式为:4ClO3-+4e-+8H+=4ClO2↑+4H2O,消耗氢离子,溶液pH值增大,故D错误;
故选;B.
点评 本题考查了电解法制备二氧化氯,明确电解池工作原理是解题关键,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
11.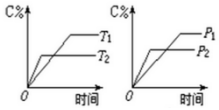 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,若升温,则K减小 | |
| B. | 达平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,若增加A的量,B的转化率增大 |
12.甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法正确的是( )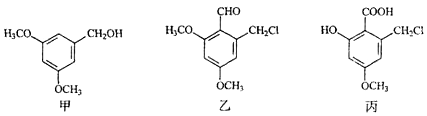

| A. | 甲、乙均能发生加成反应 | |
| B. | 甲的一种同分异构体中可能含有苯环和羧基 | |
| C. | 甲分子中的所有原子可能共平面 | |
| D. | 用酸性KMnO4溶液可鉴别乙和丙 |
6.已知碘在四氯化碳液体中的溶解度远大于在水中的溶解度,且固体碘在受热时,易直接变成气体,欲把碘从饱和碘水中分离出来,可采用的方法和主要仪器为( )
| A. | 蒸发、结晶与蒸发皿 | B. | 过滤与漏斗 | ||
| C. | 萃取、分液与分液漏斗 | D. | 蒸馏与蒸馏装置 |
16.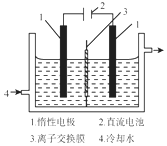 碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
(1)碘是紫黑色(填颜色)固体物质,实验室常用升华的方法来分离提纯含有少量杂质的固体碘.
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为2I--2e-=I2;每生成1molKIO3,电路中通过的电子的物质的量为6mol.
(3)若用不同种电池作为上述实验的电源,请分析电池反应:
①铅蓄电池总反应的化学方程式为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2H2O+2H2SO4,则它在充电时的阳极反应为PbSO4(s)+2H2O-2e-═PbO2+4H++SO42-;
②MnO2-Zn组成碱性干电池在放电时的负极反应为Zn-2e-+2OH-═Zn(OH)2;
③以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O.则该电池正极的电极反应为O2+2CO2+4e-═2CO32-;
④当产生相同质量的KIO3时,理论上,上述三种电池中分别消耗的Pb.Zn、丙烷的物质的量之比是10:10:1;
(4)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的实验方案,要求填写下表.
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.
试剂:淀粉溶液、淀粉-KI试纸、过氧化氢溶液、稀硫酸.
(5)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:□→□→□→□→□→□→□
步骤②的操作名称是冷却结晶,步骤⑤的操作名称是干燥.步骤④洗涤晶体的目的是洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
 碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.(1)碘是紫黑色(填颜色)固体物质,实验室常用升华的方法来分离提纯含有少量杂质的固体碘.
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为2I--2e-=I2;每生成1molKIO3,电路中通过的电子的物质的量为6mol.
(3)若用不同种电池作为上述实验的电源,请分析电池反应:
①铅蓄电池总反应的化学方程式为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2H2O+2H2SO4,则它在充电时的阳极反应为PbSO4(s)+2H2O-2e-═PbO2+4H++SO42-;
②MnO2-Zn组成碱性干电池在放电时的负极反应为Zn-2e-+2OH-═Zn(OH)2;
③以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O.则该电池正极的电极反应为O2+2CO2+4e-═2CO32-;
④当产生相同质量的KIO3时,理论上,上述三种电池中分别消耗的Pb.Zn、丙烷的物质的量之比是10:10:1;
(4)电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的实验方案,要求填写下表.
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.
试剂:淀粉溶液、淀粉-KI试纸、过氧化氢溶液、稀硫酸.
| 试验方法 | 实验现象及结论 |
步骤②的操作名称是冷却结晶,步骤⑤的操作名称是干燥.步骤④洗涤晶体的目的是洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
3.镁铝合金在碱性溶液中开始反应缓慢,后反应加快,经分析是氧化膜及微电池作用的结果.下列叙述正确的是( )
| A. | 微电池的负极是Mg | B. | 微电池的负极是Al | ||
| C. | 铝的电极反应式为2H++2e-═H2↑ | D. | 镁的电极反应式为Mg-2e-═Mg2+ |
20.下列有机物一氯代物的同分异构体数目与其他三种不同的是( )
| A. |  | B. |  | C. |  | D. |  |
1.下列操作能达到目的是( )
| A. | 将一块带有氧化膜的铝片与过量的浓NaOH溶液完全反应后,取澄清溶液将其蒸干,得纯净的NaAlO2固体 | |
| B. | 向NaAlO2溶液中加入过量的A1C13溶液,将所得沉淀过滤洗涤,加热灼烧去掉水分,可得纯净的A1(OH)3固体 | |
| C. | 把铝块与适量的稀盐酸完全反应,将所得溶液蒸干,可得AlCl3固体 | |
| D. | AlC3溶液与足量氨水反应,将沉淀过滤、洗涤、灼烧去掉水分可得Al2O3固体 |