题目内容
16.短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17g•L-1,;常温下,Y为浅黄色固体.Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol•L-1 Z的水溶液pH=13.X2、Y 和Z之间有如图转化关系(其他无关物质已略去):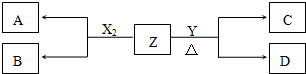
(1)写出单质X2与Z反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(2)已知16g Y完全燃烧放出148kJ热量.写出热化学方程式:S(s)+O2(g)=SO2(g);△H=-296KJ/mol.
(3)已知C能与稀硫酸反应生成能使品红溶液褪色的气体.
①写出D的电子式
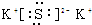 ,D的水溶液pH>7(填“=”、“>”或“<”.
,D的水溶液pH>7(填“=”、“>”或“<”.②将20mL 0.5mol•L-1C溶液逐滴加入到20mL 0.2mol•L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色.写出反应的离子方程式:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O.
分析 标准状况下X2的密度为3.17g•L-1,则相对分子质量为3.17×22.4=71,应为Cl2,Y为浅黄色固体单质,应为S,Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃),应含有K元素,且常温下,0.1mol•L-1Z的水溶液pH=13,说明Z为一元强碱,则Z为KOH,结合物质的性质以及盐类水解的原理解答该题.
解答 解:标准状况下X2的密度为3.17g•L-1,则相对分子质量为3.17×22.4=71,应为Cl2,Y为浅黄色固体单质,应为S,Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃),应含有K元素,且常温下,0.1mol•L-1Z的水溶液pH=13,说明Z为一元强碱,则Z为KOH,
(1)常温下Cl2与KOH反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)n(S)=$\frac{16g}{32g/mol}$=0.5mol,完全燃烧生成气态产物时放出148kJ热量,则1molS完全燃烧放出296kJ的热量,热化学方程式为S(s)+O2(g)=SO2(g)△H=-296kJ/mol,
故答案为:S(s)+O2(g)=SO2(g);△H=-296KJ/mol;
(3)S和KOH反应生成K2SO3和NaK2S,已知C能与硫酸反应生成能使品红溶液褪色的气体,应为SO2,则C为K2SO3,D为K2S,
①D为K2S,为离子化合物,电子式为: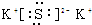 ,K2S为强碱弱酸盐,发生:SO32-+H2O?HS-+OH-;HS-+H2O?H2S+OH-,则溶液呈碱性,PH>7,
,K2S为强碱弱酸盐,发生:SO32-+H2O?HS-+OH-;HS-+H2O?H2S+OH-,则溶液呈碱性,PH>7,
故答案为: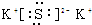 ;>;
;>;
②n(SO32-)=0.02L×0.5mol/L=0.01mol,n(MnO4-)=0.02L×0.2mol/L=0.004mol,物质的量之比为5:2,
反应的离子方程式为5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O,
故答案为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O;
点评 本题考查无机物的推断,题目难度中等,本题侧重于盐类的水解和电化学知识的考查,正确推断无机物为解答该题的关键,学习中注重相关基础知识的积累.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案| A. | 根据物质的组成和性质特点,可以将物质分成混合物和纯净物,漂白粉、钢、水玻璃、液氨都为混合物 | |
| B. | 氨基酸、蛋白质、油脂、火棉中都含有C、H、O、N四种元素 | |
| C. | 李比希法可用于有机化合物组成中碳、氢元素质量分数的测定,同位素示踪法可用于研究化学反应历程机理 | |
| D. | 大豆蛋白、鸡蛋白分别溶于水所形成的分散系为胶体,在热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质的性质都会改变并发生变性 |

为治理“白色污染”,有人提出把塑料垃圾集中,然后集中在露天焚烧,这种处理方法的弊端是造成资源浪费(写出其中一种).
| A. | 简单立方堆积 | B. | 体心立方堆积 | C. | 面心立方堆积 | D. | 六方堆积 |
 如表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | HCl | Cl2 | HClO |
| C | H2SO4 | SO2 | SO3 |
| D | CH2=CH2 | CH3CH2OH | CH3CHO |
| A. | A | B. | B | C. | C | D. | D |
下列有关说法正确的是( )
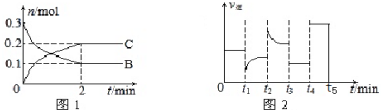
| A. | x=2.反应开始2min内,v(A)=0.05 mol•L-1•min-1 | |
| B. | 若tl时改变的条件是降温,平衡正向移动,则该反应为放热反应 | |
| C. | 若t2时改变的条件是增大c的浓度,则t2时正反应速率减小 | |
| D. | t3-t5时间段B的浓度一定未发生变化 |
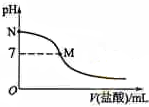 298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )| A. | 该滴定过程应该选择石蕊作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<12 |
| A. | CH4 | B. | C3H4 | C. | C2H4 | D. | C4H8 |
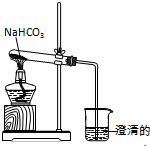 实验室利用图所示装置进行NaHCO3的受热分解实验.
实验室利用图所示装置进行NaHCO3的受热分解实验.