题目内容
6.在20℃时,某气态烃与氧气混合装入密闭容器中,点燃爆炸后,又恢复到20℃.此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎真空.此烃的化学式可能是( )| A. | CH4 | B. | C3H4 | C. | C2H4 | D. | C4H8 |
分析 反应后加NaOH的溶液则气体全部被吸收,说明气态烃与氧气混合后恰好完全反应生成生成二氧化碳和水,压强减小至原来的一半,压强之比等于物质的量之比,容器内反应后气体的物质的量为是反应前的一半,恢复到20℃,水为液体,结合方程式计算.
解答 解:设此烃的化学式为CxHy,则有
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O
1 x+$\frac{y}{4}$ x
体积减小至原来的一半,可知1+x+$\frac{y}{4}$=2x,
整理可得:4x=4+y,
若x=1,则y=0,不存在此物质,
若x=2,则y=4,物质为C2H4,
若x=3,则y=8,物质为C3H8,
故选C.
点评 本题考查了利用方程式进行的讨论计算,题目难度不大,关键判断烃与氧气混合后恰好完全反应生成生成二氧化碳和水,再依据化学方程式中气体前面的化学计量数进行计算.

练习册系列答案
相关题目
1.下列各项因素中能够对化学反应速度起决定作用的是( )
| A. | 温度 | B. | 浓度 | C. | 催化剂 | D. | 物质性质 |
11.碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离.关于Ki1和Ki2说法正确的是( )
| A. | Ki1的表达式为Ki1=$\frac{c({H}_{2}C{O}_{3})}{C({H}^{+})•C(HC{{O}_{3}}^{-})}$ | |
| B. | Ki2对应的电离过程是HCO3-+H2O≒H2CO3+OH- | |
| C. | 当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 | |
| D. | 改变条件使Ki1减小,则Ki2一定也减小 |
18.下列离子方程式错误的是( )
| A. | 碳酸氢镁与氢氧化钠反应:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O | |
| B. | 溴化亚铁溶液中通入过量的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 碳酸钙中滴入醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
15. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 含 T 的盐溶液一定显酸性 | |
| C. | 原子半径:T>Q>R | |
| D. | 最高价氧化物对应水化物的酸性:Q<W |
16.如图所示,下列叙述正确的是( )
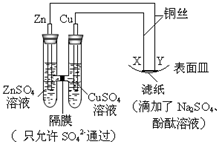

| A. | X为阴极,发生还原反应 | |
| B. | 电子沿Zn→Y→X→Cu路径流动 | |
| C. | Na+移向Y,与滤纸接触处有氧气生成 | |
| D. | Y与滤纸接触处变红 |
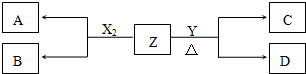
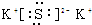 ,D的水溶液pH>7(填“=”、“>”或“<”.
,D的水溶液pH>7(填“=”、“>”或“<”. ;
; ;
;