题目内容
13.ClO2是一种黄色气体,极易爆炸,有多种制名方法,较安全的是:NaClO3+SO2+H2SO4-NaHSO4+ClO2,氧化剂与还原剂的物质的量之比是2:1.分析 NaClO3+SO2+H2SO4-NaHSO4+ClO2,其中Cl元素的化合价降低,则SO2中S元素的化合价升高,则NaClO3为氧化剂,SO2为还原剂,根据氧化剂还原剂得失电子守恒计算氧化剂与还原剂的物质的量之比.
解答 解:NaClO3+SO2+H2SO4-NaHSO4+ClO2,其中Cl元素的化合价由+5→+4,降低1价,则NaClO3为氧化剂,SO2中S元素的化合价由+4→+6,升高2价,则SO2为还原剂,根据得失电子守恒,氧化剂与还原剂的物质的量之比为2:1,
故答案为:2:1.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价的角度分析,计算时注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.将pH为5的盐酸溶液稀释500倍,稀释后溶液中c(Cl-)和c(H+)之比约为( )
| A. | 1:2 | B. | 1:5 | C. | 1:10 | D. | 10:1 |
1.下列叙述正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种活动性不同的金属 | |
| B. | 由CH4、O2和KOH构成的燃料电池中,通入CH4的电极为正极 | |
| C. | 原电池工作时,负极发生氧化反应,化合价降低 | |
| D. | 铜锌原电池工作时,当有13 g锌溶解时,电路中有0.4 mol电子通过 |
8.关于氯水的叙述不正确的是( )
| A. | 氯气和液氯是两种不同物质 | |
| B. | 新制氯水溶液中存在两个平衡状态 | |
| C. | 久置的氯水,溶液的PH会变小 | |
| D. | 向氯水中滴加紫色石蕊试剂,溶液先变红后褪色 |
18.在48mL0.1mol/L硫酸溶液中加入4.7mL0.05mol/L氢氧化钠溶液,充分反应后,假若混合溶液的体积是酸、碱溶液体积的加和,则溶液中的c(H+)( )
| A. | 0.9mol/L | B. | 0.18mol/L | C. | 0.42mol/L | D. | 0.84mol/L |
5.胶体分散系在日常生活中很常见.下列说法不正确的是( )
| A. | 将饱和的FeCl3溶液滴入沸水中形成Fe(OH)3胶体 | |
| B. | 蛋白质溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都不在1~100 nm之间 |
3.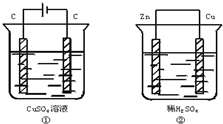 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )| A. | 产生气体的体积:①>② | |
| B. | 电极总质量的变化:①增加,②减小 | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①装置中的阳极:4OH--4e-→2H2O+O2↑ ②装置中的负极:2H++2e-→H2↑ |
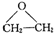 ,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$
,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$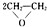 .
. ,
, ,
,