题目内容
NaCl晶体中钠和氯离子周围都是由六个相反离子按八面体形状排列的,解释这样的结构可以用( )
| A、杂化轨道 | B、键的极性 |
| C、离子大小 | D、离子电荷 |
考点:离子晶体
专题:
分析:在氯化钠晶体中 每个氯离子的周围都有6个钠离子,每个钠离子的周围也有6个氯离子,较大的氯离子排成立方最密堆积,较小的钠离子则填充氯离子之间的八面体的空隙.每个离子周围都被六个其他的离子包围着,钠离子和氯离子就是按照这种排列方式向空间各个方向伸展 形成氯化钠晶体.
解答:
解:在氯化钠晶体中 每个氯离子的周围都有6个钠离子,每个钠离子的周围也有6个氯离子,较大的氯离子排成立方最密堆积,较小的钠离子则填充氯离子之间的八面体的空隙.每个离子周围都被六个其他的离子包围着,钠离子和氯离子就是按照这种排列方式向空间各个方向伸展 形成氯化钠晶体.故可以用离子大小来解释NaCl晶体中钠和氯离子周围都是由六个相反离子按八面体形状排列的,
故选C.
故选C.
点评:本题考查氯化钠晶体的结构,难度不大.要注意掌握氯化钠晶体的结构和性质.

练习册系列答案
相关题目
在一密闭绝热容器中,发生放热反应:SO2(g)+NO2(g)?SO3(g)+NO(g),下列有关说法正确的是( )
| A、反应达到平衡时,降低温度,平衡逆向移动 |
| B、使用催化剂,正反应速率增大,逆反应速率减小 |
| C、若反应体系温度不再变化,说明反应达到平衡状态 |
| D、减小SO2的浓度,平衡正向移动 |
某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度.有关的叙述正确的是( )
| A、H2Y的电离方程式为:H2Y=2H++Y2- |
| B、在该酸式盐溶液中:[Na+]>[Y2-]>[HY-]>[OH-]>[H+] |
| C、HY-的水解方程式:HY-+H2O?H3O++Y2- |
| D、在该酸式盐溶液中:[Na+]>[HY-]>[OH-]>[H+]>[Y2-] |
常温下,向VmL浓度为cmol/L的CH3COOH溶液中逐滴加入2VmL相同物质的量浓度的NaOH溶液,下列有关叙述正确的是( )
| A、原CH3COOH溶液中c(H+)与NaOH溶液中c(OH-)相等 |
| B、此过程溶液中水的电离程度先增大后减小,溶液的pH增大 |
| C、加至VmL时,溶液呈中性 |
| D、加至2VmL时,溶液中c(CH3COO-)+c(CH3COOH)=c(OH-)-c(H+) |
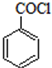 )是合成药品的重要中间体.请写出以苯、乙醚、甲醛为原料制备苯甲酰氯的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)是合成药品的重要中间体.请写出以苯、乙醚、甲醛为原料制备苯甲酰氯的合成路线流程图(无机试剂任用).合成路线流程图示例如下: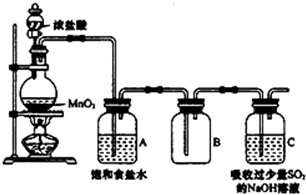 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示: