题目内容
常温下,向VmL浓度为cmol/L的CH3COOH溶液中逐滴加入2VmL相同物质的量浓度的NaOH溶液,下列有关叙述正确的是( )
| A、原CH3COOH溶液中c(H+)与NaOH溶液中c(OH-)相等 |
| B、此过程溶液中水的电离程度先增大后减小,溶液的pH增大 |
| C、加至VmL时,溶液呈中性 |
| D、加至2VmL时,溶液中c(CH3COO-)+c(CH3COOH)=c(OH-)-c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:向VmL浓度为cmol/L的CH3COOH溶液中逐滴加入2VmL相同物质的量浓度的NaOH溶液,开始碱不足,溶质为醋酸和醋酸钠,加VmLNaOH时恰好生成醋酸钠,水解显碱性;加至2VmL时,溶液含等量的醋酸钠和NaOH,结合物料守恒及电荷守恒解答.
解答:
解:A.醋酸为弱酸,不能完全电离,而NaOH为强碱,等浓度时CH3COOH溶液中c(H+)与NaOH溶液中c(OH-)不相等,故A错误;
B.加碱时,氢离子浓度减小,水的电离程度增大,恰好完全反应时生成盐水解促进电离,碱过量时抑制水的电离,且氢氧根离子浓度在增大,则此过程溶液中水的电离程度先增大后减小,溶液的pH增大,故B正确;
C.加VmLNaOH时恰好生成醋酸钠,水解显碱性,故C错误;
D.加至2VmL时,溶液含等量的醋酸钠和NaOH,c(CH3COO-)+c(CH3COOH)=
c(Na+),存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),可知c(OH-)=c(H+)+2c(CH3COOH)+c(CH3COO-),即c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+),故D错误;
故选B.
B.加碱时,氢离子浓度减小,水的电离程度增大,恰好完全反应时生成盐水解促进电离,碱过量时抑制水的电离,且氢氧根离子浓度在增大,则此过程溶液中水的电离程度先增大后减小,溶液的pH增大,故B正确;
C.加VmLNaOH时恰好生成醋酸钠,水解显碱性,故C错误;
D.加至2VmL时,溶液含等量的醋酸钠和NaOH,c(CH3COO-)+c(CH3COOH)=
| 1 |
| 2 |
故选B.
点评:本题考查酸碱混合的定性及离子浓度大小比较,为高频考点,综合考查学生的分析能力和化学基本理论的运用能力,题目难度中等,注意电荷守恒的运用.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
NaCl晶体中钠和氯离子周围都是由六个相反离子按八面体形状排列的,解释这样的结构可以用( )
| A、杂化轨道 | B、键的极性 |
| C、离子大小 | D、离子电荷 |
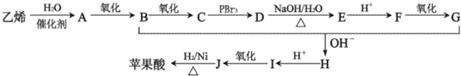
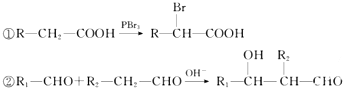
 )是一种重要的有机原料,用该物质可合成其他物质.
)是一种重要的有机原料,用该物质可合成其他物质.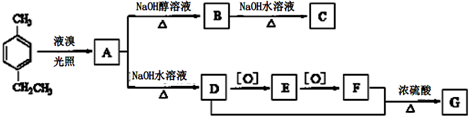
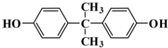 )与光气(
)与光气(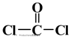 )聚合得到,请写出该聚碳酸酯的结构简式
)聚合得到,请写出该聚碳酸酯的结构简式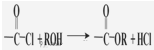 )
)
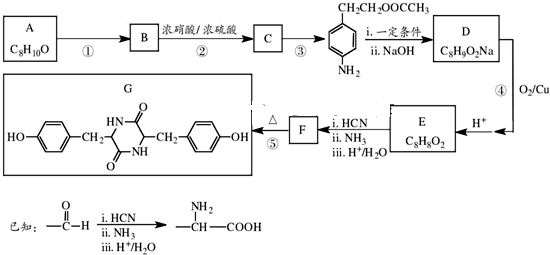
 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2