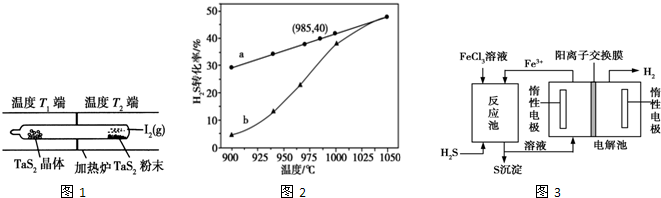
题目内容
9.可逆反应A(g)+3B(g)?2C(g)△H=-QkJ/mol(Q>0).有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2.下列叙述正确的是( )| A. | 甲中反应达到平衡时,Q1=Q | |
| B. | 达到平衡后,甲中C的体积分数比乙大 | |
| C. | 达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g)△H=+Q2kJ/mol |
分析 A.可逆反应不能完全反应,甲参加反应的A小于1mol;
B.甲容器中开始加入1molA的和3molB与乙容器中开始加入2mol C为完全等效平衡,平衡时同种物质的含量相同;
C.甲容器中开始加入1molA的和3molB与乙容器中开始加入2mol C为完全等效平衡,平衡时相同组分的物质的量相等,设甲中平衡时C为xmol,则乙中反应的C为(2-x)mol,由于Q2=3Q1,则(2-x)mol=3xmol,解得x=0.5,则平衡体系中A为0.5mol、B为1.5mol、C为1mol,再向乙中加入0.25molA、0.75molB、1.5molC,等效为增大压强,平衡向气体体积减小的方向移动;
D.可逆反应不能完全反应,2molC分解吸收的热量大于Q2kJ.
解答 解:A.可逆反应不能完全反应,甲参加反应的A小于1mol,故甲中反应达到平衡时Q1<Q,故A错误;
B.甲容器中开始加入1molA的和3molB与乙容器中开始加入2mol C为完全等效平衡,平衡时同种物质的含量相同,则C的体积分数相等,故B正确;
C.甲容器中开始加入1molA的和3molB与乙容器中开始加入2mol C为完全等效平衡,平衡时相同组分的物质的量相等,设甲中平衡时C为xmol,则乙中反应的C为(2-x)mol,由于Q2=3Q1,则(2-x)mol=3xmol,解得x=0.5,则平衡体系中A为0.5mol、B为1.5mol、C为1mol,再向乙中加入0.25molA、0.75molB、1.5molC,等效为增大压强,平衡向气体体积减小的方向移动,即向生成C的方向移动,故C正确;
D.可逆反应不能完全反应,2molC分解吸收的热量大于Q2kJ,乙中热化学方程式为:2C(g)?A(g)+3B(g)△H=+QkJ/mol,故D错误,
故选:C.
点评 本题考查了化学平衡的计算、化学平衡建立、可逆反应特征等,题目难度中等,关键是等效平衡的应用,旨在培养学生灵活运用基础知识解决实际问题的能力.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案| A. | 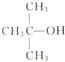 、CH3OH和浓硫酸共热 、CH3OH和浓硫酸共热 | B. | 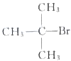 和CH3ONa共热 和CH3ONa共热 | ||
| C. | CH3Br和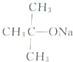 共热 共热 | D. |  和CH3OH在Al2O3存在下共热 和CH3OH在Al2O3存在下共热 |
| A. | 10 | B. | 34 | C. | 44 | D. | 78 |
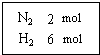 在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中(如右图)发生以下的反应:
在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中(如右图)发生以下的反应: