题目内容
14.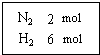 在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中(如右图)发生以下的反应:
在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中(如右图)发生以下的反应:N2(g)+3H2(g)?2NH3(g) (正反应为放热反应)
若反应达到平衡后,测得混和气体为7mol,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a=1mol,c=2mol,则b=3 mol,在此情况下,反应起始时将向逆反应方向进行(填“正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是1<c<4.
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5mol,则可采取的措施是降低温度.
分析 在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中,
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 6 0
变化量(mol):x 3x 2x
平衡量(mol):2-x 6-3x 2x
若反应达到平衡后,测得混和气体为7mol,则2-x+6-3x+2x=7,解得x=0.5.
(1)改变起始投料量,平衡时各物质的物质的量分数仍与原平衡时完全相同,为等效平衡,恒温恒容下,按化学计量数转化到方程式左边满足投料量相等,即满足n(N2)=2mol、n(H2)=6mol;
根据平衡时同种组分的物质的量判断反应进行方向;
(2)若规定起始时反应向逆反应方向进行,则氨气物质的量应大于原平衡时的物质的量,氨气完全转化得到2mol氮气、6mol氢气达极大值;
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5mol,应使平衡正向移动.
解答 解:在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中,
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 6 0
变化量(mol):x 3x 2x
平衡量(mol):2-x 6-3x 2x
若反应达到平衡后,测得混和气体为7mol,则2-x+6-3x+2x=7,解得x=0.5.
(1)改变起始投料量,平衡时各物质的物质的量分数仍与原平衡时完全相同,为等效平衡,恒温恒容下,按化学计量数转化到方程式左边满足投料量相等,即满足n(N2)=2mol、n(H2)=6mol,则1+$\frac{1}{2}$×2mol=2mol、b+$\frac{3}{2}$×2mol=6mol,故b=3mol;
原平衡时氮气为1.5mol,大于1mol,故反应向逆反应方向进行,
故答案为:3;逆反应;
(2)若规定起始时反应向逆反应方向进行,则氨气物质的量应大于原平衡时的物质的量,故c>1mol,氨气完全转化得到2mol氮气、6mol氢气达极大值,氨气极大值为2mol×2=4mol,故c的取值范围为:1<c<4,
故答案为:1<c<4;
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5mol,应使平衡正向移动,正反应为放热反应,可以降低温度使平衡正向移动,
故答案为:降低温度.
点评 本题考查化学平衡计算与影响因素,侧重考查等效平衡,关键是对等效平衡规律的理解掌握.

| A. |  干燥Cl2 | |
| B. |  配制90ml 0.1mol•L-1硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
| A. | 甲中反应达到平衡时,Q1=Q | |
| B. | 达到平衡后,甲中C的体积分数比乙大 | |
| C. | 达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g)△H=+Q2kJ/mol |
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度 为700℃
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数 K等于1.0(填“大于”“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动(填“向正反应方向”“向逆反应方向”或“不”).
(6)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为逆反应方向(填“正反应方向”“逆反应方向”或“不移动”)
| A. | 常温下,反应C(s)+H2O(g)═CO(g)+H2(g)不能自发进行,则该反应的△H>0 | |
| B. | 一定温度下,反应MgCl2(l)═Mg(l)+Cl2(g)的△H>0,△S<0 | |
| C. | 放热的自发过程,一定是熵增加的过程 | |
| D. | 液态水可自发挥发成水蒸气的过程是熵减的过程 |
| 实验目的 | 试剂及方法 |
| 除去细沙中混有的碘 | A |
| 证明某些雨水样品呈酸性 | C |
| 鉴别甲烷和乙烯 | D |
| 除去开水壶内壁的水垢 | B |
B.加适量的食醋振荡
C.用pH试纸测定溶液pH
D.分别通入酸性高锰酸钾溶液.
 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),120s时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白:
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),120s时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白: