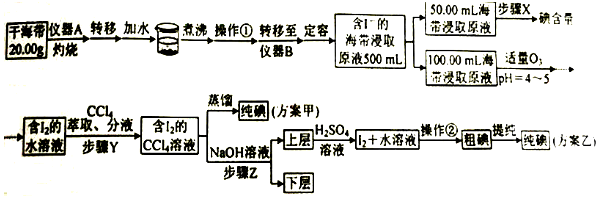
题目内容
2.氯化铁和氯化铜溶于足量水形成的溶液中含有0.8mol氯离子,且溶液中铜元素物质的量为铁元素的一半.现要使原溶液中的金属阳离子都转化为亚铁离子,需加铁粉( )| A. | 5.6g | B. | 11.2g | C. | 16.8g | D. | 22.4g |
分析 设FeCl3,CuCl2,的物质的量分别为2xmol,xmol,则3×2x+2x=0.8,在氯化铁和氯化铜的混合溶液中加入铁粉,分别发生:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,据此进行分析所加铁粉的质量,
解答 解:设FeCl3,CuCl2,的物质的量分别为2xmol,xmol,则3×2x+2x=0.8,则x=0.1mol,
则n(FeCl3)=0.2mol,n(CuCl2)=0.1mol,
根据元素守恒则n(Fe3+)=0.2mol,n(Cu2+)=0.1mol,
2Fe3++Fe=3Fe2+
2 1
0.2 0.1
Fe+Cu2+=Fe2++Cu
1 1
0.1 0.1
则n(Fe)=0.1mol+0.1mol=0.2mol,m(Fe)=0.2mol×56g/mol=11.2g,
故选B.
点评 本题考查混合物的计算,注意把握铁与氯化铁和氯化铜反应的方程式的书写,根据质量关系结合方程式计算,题目难度不大.

练习册系列答案
相关题目
12.有关蔗糖与浓硫酸的反应,下列说法错误的有( )
| A. | 浓硫酸表现出酸性 | B. | 浓硫酸表现出脱水性 | ||
| C. | 浓硫酸表现出吸水性 | D. | 浓硫酸表现出强氧化性 |
10.下列由实验现象得出的结论一定正确的是( )
| 操作及现象 | 结论 | |
| A | 向PbSO4悬浊液中加入KI溶液时出现黄色沉淀 | Ksp(PbI2)<Ksp(PbSO4) |
| B | 向某溶液中滴加氯水后再加入稀C6H5OH溶液,溶液呈红色 | 原溶液中可能含有Fe2+ |
| C | 向Na2SiO3溶液中通入过量SO2气体 | 反应为:SiO${\;}_{3}^{2-}$+SO2+H2O=H2SiO3↓+SO${\;}_{3}^{2-}$ |
| D | 将氢气还原氧化铜所得的红色固体加入足量稀硝酸中,溶液变为蓝色 | 反应为:3Cu+2NO${\;}_{3}^{-}$+8H+=3Cu2++2NO↑+4H2O |
| A. | A | B. | B | C. | C | D. | D |
17.化学与上产、生活密切相关,下列叙述中正确的是( )
| A. | 在游泳池中常加CuSO4和漂白粉,它们使细菌蛋白质变性的原理相同 | |
| B. | 铜制品在潮湿空气中生锈,其主要原因是发生吸氧腐蚀 | |
| C. | “地沟油”禁止食用,但可以用来制肥皂,是利用了皂化反应 | |
| D. | 利用K2FeO4作水处理剂是因为它既有吸附性又有强氧化性 |
7.纵观古今,化学与生活有着密切联系.下列有关说法错误的是( )
| A. | “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同 | |
| B. | 制作烟花的过程中常加入金属发光剂和发色剂烟花放出五彩缤纷的颜色 | |
| C. | 草莓棚中使用的“吊带式二氧化碳气肥”的主要成分可以是碳酸钙 | |
| D. | 《本草纲目》记载的“凡酸坏之酒,皆可蒸烧”的实验方法可用来分离乙酸和乙醇 |
4.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 稀HNO3中加入过量的Fe 粉,充分反应后,滴入KSCN 溶液 | 溶液呈红色 | 稀HNO3将Fe 氧化为Fe3+ |
| B | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | Al 箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密了氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
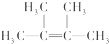 名称为2,3-二甲基-2-丁烯.
名称为2,3-二甲基-2-丁烯.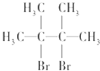 .
. .
.