题目内容
17.化学与上产、生活密切相关,下列叙述中正确的是( )| A. | 在游泳池中常加CuSO4和漂白粉,它们使细菌蛋白质变性的原理相同 | |
| B. | 铜制品在潮湿空气中生锈,其主要原因是发生吸氧腐蚀 | |
| C. | “地沟油”禁止食用,但可以用来制肥皂,是利用了皂化反应 | |
| D. | 利用K2FeO4作水处理剂是因为它既有吸附性又有强氧化性 |
分析 A.铜离子为重金属离子,漂白粉有强的氧化性,据此解答;
B.潮湿空气中,铜与杂质容易形成原电池;
C.油脂碱性条件下水解,可生成肥皂;
D.K2FeO4具有强的氧化性,还原生成的三价铁离子水解生成具有吸附性的氢氧化铁胶体,据此解答.
解答 解:A.在游泳池中常加CuSO4和漂白粉,它们使细菌蛋白质变性的原理不相同,铜离子因为其为重金属离子,漂白粉中次氯酸钙具有强的氧化性,故A错误;
B.潮湿空气中,铜与杂质容易形成原电池,发生吸氧腐蚀,故B正确;
C.地沟油的主要成分是油脂,油脂碱性条件下水解成为肥皂,该反应为皂化反应,可生成肥皂,故C正确;
D.高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,故D错误;
故选:BC.
点评 本题考查了元素化合物知识,明确蛋白质变性方法、优质的性质、原电池工作原理是解题关键,题目难度不大.

练习册系列答案
相关题目
5.冰岛火山爆发再一次向人类敲响了警钟,必须发展“低碳经济”.氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备思青睐.下列不是氢优点的是( )
| A. | 原料来源广 | B. | 易燃烧,放出热量多 | ||
| C. | 产物无污染 | D. | 制取H2简单易行 |
12.下图是应用电化学方法检测空气中SO2的原理示意图,下列有关说法不正确的是( )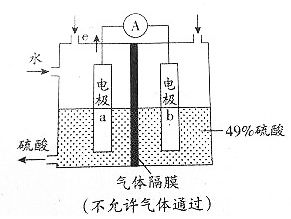

| A. | 该装置工作时能将化学能转化为电能,并有H2SO4生成 | |
| B. | 电极b表面O2发生还原反应,电极b附近溶液的pH升高 | |
| C. | 气体样品从电极a区域通入,样品中的SO2在电极a表面得到电子 | |
| D. | 电极a表面发生的电极反应时为SO2+2H2O-2e-=${SO}_{4}^{2-}$+4H+ |
2.氯化铁和氯化铜溶于足量水形成的溶液中含有0.8mol氯离子,且溶液中铜元素物质的量为铁元素的一半.现要使原溶液中的金属阳离子都转化为亚铁离子,需加铁粉( )
| A. | 5.6g | B. | 11.2g | C. | 16.8g | D. | 22.4g |
19.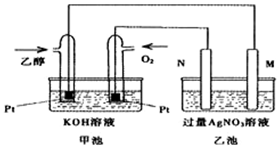 已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
(1)图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是C.
A.M电极的材料是石墨
B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448mL
C.在此过程中,甲池中OH-向通乙醇的一极移动
D.在此过程中,乙池溶液中电子从M电极向N电极移动
(2)写出乙醇燃料电池正极的电极反应式O2+2H2O+4e-=4OH-.
(3)已知:甲醇脱水反应 ①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1
甲醇制烯烃反应 ②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2
乙醇异构化反应 ③CH3CH2OH(g)=CH3OCH3(g))?△H3
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=△H1-△H2-△H3(用含△H1、△H2、△H3表示).
(4)工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
①据表信息推导出K1、K2与K3之间的关系,K3=K1K2用K1、K2表示).
②反应②是吸热反应(选填“吸热”“放热”).
 已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:(1)图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是C.
A.M电极的材料是石墨
B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448mL
C.在此过程中,甲池中OH-向通乙醇的一极移动
D.在此过程中,乙池溶液中电子从M电极向N电极移动
(2)写出乙醇燃料电池正极的电极反应式O2+2H2O+4e-=4OH-.
(3)已知:甲醇脱水反应 ①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1
甲醇制烯烃反应 ②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2
乙醇异构化反应 ③CH3CH2OH(g)=CH3OCH3(g))?△H3
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=△H1-△H2-△H3(用含△H1、△H2、△H3表示).
(4)工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
②反应②是吸热反应(选填“吸热”“放热”).

 .
.