题目内容
3.某烃A的相对分子质量为84.回答下列问题:(1)烃A的分子式为C6H12.
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种.
①A的结构简式为
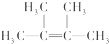 名称为2,3-二甲基-2-丁烯.
名称为2,3-二甲基-2-丁烯.②链烃A与Br2的CCl4溶液反应生成B,写出由A生成B的化学方程式:
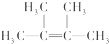 +Br2→
+Br2→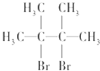 .
.③与A互为同分异构体,且主链碳原子个数与A相同的链烃有2种(不包括A)
(3)若A不能使Br2的CCl4溶液褪色,且其一氯代物只有一种,则A的结构简式为
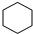 .
.
分析 (1)烃A的相对分子质量为84,则该烃可能为烯烃或环烷烃,分子式应为C6H12;
(2)①若烃A为链烃,应含有一个碳碳双键,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则A为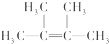 ,据结构简式进行命名;
,据结构简式进行命名;
②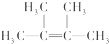 与Br2发生2,3位加成反应,生成则B为
与Br2发生2,3位加成反应,生成则B为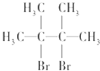 ;
;
③与A互为同分异构体,且主链碳原子个数与A相同的链烃有:CH2=C(CH2)CH(CH3)2,CH2=CHC(CH3)3;
(3)若A不能使溴水褪色,没有不饱和键,且其一氯代物只有一种,则A为环己烷.
解答 解:(1)烃A的相对分子质量为84,则该烃可能为烯烃或环烷烃,分子式应为C6H12,
故答案为:C6H12;
(2)①若烃A为链烃,应含有一个碳碳双键,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则A为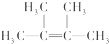 ,名称为:2,3-二甲基-2-丁烯,
,名称为:2,3-二甲基-2-丁烯,
故答案为: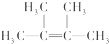 ;2,3-二甲基-2-丁烯;
;2,3-二甲基-2-丁烯;
②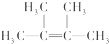 与Br2发生2,3位加成反应,生成则B为
与Br2发生2,3位加成反应,生成则B为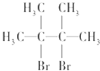 ,故方程式为
,故方程式为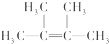 +Br2→
+Br2→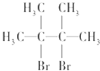 ,
,
故答案为: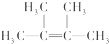 +Br2→
+Br2→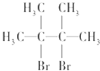 ;
;
③与A互为同分异构体,且主链碳原子个数与A相同的链烃有:CH2=C(CH2)CH(CH3)2,CH2=CHC(CH3)3,
故答案为:2;
(3)若A不能使溴水褪色,且其一氯代物只有一种,则A为环己烷,结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物推断、有机物燃烧耗氧量问题、限制条件同分异构体书写等,题目比较综合,是对基础知识的综合考查,难度中等.

练习册系列答案
相关题目
1.阿司匹林(主要成分为乙酰水杨酸)是解热止痛、治疗感冒的药物.它是由水杨酸(邻羟基苯甲酸)与醋酸酐进行酯化反应制得的.其反应原理如下:
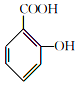 +
+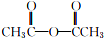 $→_{75-80℃}^{H_{3}PO_{4}}$
$→_{75-80℃}^{H_{3}PO_{4}}$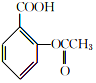 +CH3COOH
+CH3COOH
为避免醋酸酐水解,所用原料、仪器要充分干燥.有关物质的参数如表:
制取阿司匹林的工艺流程如下:
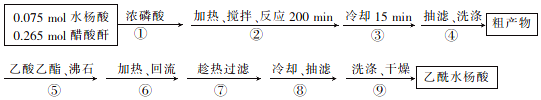
回答下列问题:
(1)浓磷酸的作用是催化剂.步骤②的加热方式为水浴加热,温度控制在75~80℃.
(2)向粗产物中加入乙酸乙酯的作用是溶解水杨酸和醋酸酐等杂质,同时减少乙酰水杨酸因溶解而造成的损失.
(3)验证最后得到的乙酰水杨酸产品较为纯净的方法是测定产品熔点.
(4)精制后乙酰水杨酸的质量为8.91g,则其产率为66%,造成产率低的原因可能有反应温度没有控制好(或粗产品回流时的温度过高,造成产品水解发生副反应等)(任写一点).
 +
+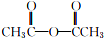 $→_{75-80℃}^{H_{3}PO_{4}}$
$→_{75-80℃}^{H_{3}PO_{4}}$ +CH3COOH
+CH3COOH为避免醋酸酐水解,所用原料、仪器要充分干燥.有关物质的参数如表:
| 名称 | 式量 | 性质 | 熔点/℃ | 沸点/℃ | 溶解度 | ||
| 水 | 乙醇 | 乙酸乙酯 | |||||
| 水杨酸 | 138 | 白色结晶粉末、无臭 | 157~159 | 211 | 溶 | 易溶 | 易溶 |
| 醋酸酐 | 102 | 无色液体、易燃、有醋酸味 | -73.1 | 138.6 | 易溶 | 溶 | 易溶 |
| 乙酸水杨酸 | 180 | 白色针状结晶 | 135 | 321.4 | 冰水微溶、热水可溶 | 易溶 | 微溶 |

回答下列问题:
(1)浓磷酸的作用是催化剂.步骤②的加热方式为水浴加热,温度控制在75~80℃.
(2)向粗产物中加入乙酸乙酯的作用是溶解水杨酸和醋酸酐等杂质,同时减少乙酰水杨酸因溶解而造成的损失.
(3)验证最后得到的乙酰水杨酸产品较为纯净的方法是测定产品熔点.
(4)精制后乙酰水杨酸的质量为8.91g,则其产率为66%,造成产率低的原因可能有反应温度没有控制好(或粗产品回流时的温度过高,造成产品水解发生副反应等)(任写一点).
2.氯化铁和氯化铜溶于足量水形成的溶液中含有0.8mol氯离子,且溶液中铜元素物质的量为铁元素的一半.现要使原溶液中的金属阳离子都转化为亚铁离子,需加铁粉( )
| A. | 5.6g | B. | 11.2g | C. | 16.8g | D. | 22.4g |
11.一种气态烷烃和一种气态烯烃组成的混合物共11.6g,混合气体的密度是相同状况下H2密度的14.5倍,该混合气体通过Br2水时,Br2水的质量增加8.4g,则组成该混合气体的可能是( )
| A. | 甲烷、乙烯 | B. | 乙烷、乙烯 | C. | 乙烷、丙烯 | D. | 甲烷、丙烯 |
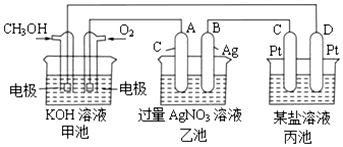
12.工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”.并能以它们为原料生产一系列化工产品.为提高原料的利用率,节能降耗.设计如图1所示工艺流程,其中氯碱工业装置中的电极未标出.
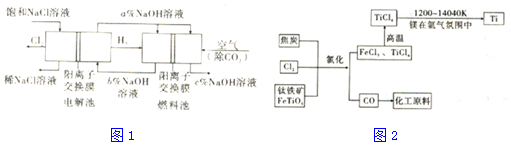
(1)电解饱和食盐水的化学方程式为2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是B (填序号).
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③B.①②⑤④①③C.①②④⑤③D.④②⑤
(3)图中NaOII溶液的质量分数a%、b%、c%,由大到小的顺序为c%>a%>b%.
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的四种钠盐溶液pH如表,下列说法不正确的是BD(填序号).
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐58.5t.
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图2.写出钛铁矿经氯化法得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO.
(7)氮气和氩气是两种化学性质相对稳定的气体.镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气.试用化学反应方程式解释不选用氮气的原因:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2.

(1)电解饱和食盐水的化学方程式为2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是B (填序号).
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③B.①②⑤④①③C.①②④⑤③D.④②⑤
(3)图中NaOII溶液的质量分数a%、b%、c%,由大到小的顺序为c%>a%>b%.
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的四种钠盐溶液pH如表,下列说法不正确的是BD(填序号).
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐58.5t.
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图2.写出钛铁矿经氯化法得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO.
(7)氮气和氩气是两种化学性质相对稳定的气体.镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气.试用化学反应方程式解释不选用氮气的原因:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2.
13. 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )| A. | W、与X、Y、Z形成的化合物均是共价化合物 | |
| B. | 简单离子半径:Z>Y>X | |
| C. | X、Y、Z形成的化合物水溶液一定呈碱性 | |
| D. | X、Y形成的化合物一定含有离子键 |
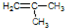 .
. .
. 的系统命名是2,6-二甲基辛烷.
的系统命名是2,6-二甲基辛烷.