题目内容
16.下列除去杂质的方法中正确的是( )| A. | Cl2中混有少量HCl:通过盛有足量硝酸银溶液的洗气瓶洗气 | |
| B. | Cl2中混有少量水蒸气:先通过足量浓硫酸,再用向下排空气法收集氯气 | |
| C. | HCl中混有少量Cl2:通过盛有四氯化碳的洗气瓶洗气 | |
| D. | HCl中混有少量Cl2:通入足量氢气并光照 |
分析 A.二者均与硝酸银溶液反应;
B.氯气的密度比空气的密度大;
C.氯气可溶解在四氯化碳中,而HCl不能;
D.氢气过量,引入新杂质.
解答 解:A.硝酸银溶液也可以吸收氯气,应选饱和食盐水、洗气分离,故A错误;
B.应该用向上排空气法收集氯气,故B错误;
C.四氯化碳可以吸收氯气,则通过盛有四氯化碳的洗气瓶洗气可除杂,故C正确;
D.氢气过量,会引入氢气杂质,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法等为解答的关键,侧重分离提纯试剂选择及方法的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
6.下列实验装置能达到实验目的是( )
| A. |  进行喷泉实验 | B. |  加热熔融NaOH固体 | ||
| C. |  验证镁片与稀盐酸反应放热 | D. |  测定过氧化氢的纯度 |
7.“84”消毒液有效成分为 NaClO,已知酸的电离平衡常数 H2CO3>HClO>HCO3- 下列说法正确的是( )
| A. | “84”消毒液可以与福尔马林溶液混合使用 | |
| B. | NaClO的稳定性和漂白性都比HClO强 | |
| C. | 工业上在特定条件下电解饱和食盐水制得NaClO,原理为:NaCl+H2O═NaClO+H2↑ | |
| D. | NaClO溶液在空气中发生离子反应为:2ClO-+CO2+H2O═2HClO+CO32- |
4.在下面的反应中,氨作为氧化剂参加反应的是( )
| A. | NH3+H3PO4═NH4H2PO4 | |
| B. | 4NH3+5O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$4NO+6H2O | |
| C. | 2NH3+3Cl2═6HCl+N2 | |
| D. | NH3+NaH═NaNH2+H2↑ |
11.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| B. | 铝粉与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| C. | 利用腐蚀法制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 在氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
1.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 一定条件下,1 mol N2与足量H2反应生成NH3,转移电子6NA | |
| C. | 1L0.1 mol•L-1(NH4)2SO4溶液中含有0.2NA个NH4+ | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
8.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | S$→_{燃烧}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | CuSO4(aq)$\stackrel{过量NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
5.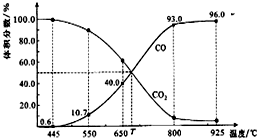 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )
 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正,?逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为放热反应 |
