题目内容
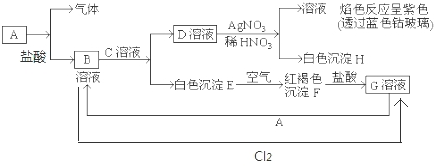
8.已知A为单质,与某物质反应生成气体与B.有以下物质相互转化;
试回答:(1)写出B的化学式FeCl2;D的化学式KCl;
(2)写出由E转变成F的化学方程式4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)写出G溶液中加入铜粉反应的离子方程式2Fe3++Cu═2Fe2++Cu2+.
分析 白色沉淀E在空气中转化为红褐色沉淀F,则E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应得到G,G与单质A反应得到B,结合转化关系及元素守恒可知,A为Fe,G为FeCl3,B为FeCl2,B与C溶液反应得到D,D与AgNO3生成白色沉淀H,可知H为AgCl,透过蓝色钴玻璃观察焰色反应为紫色,可知D溶液中含有K+,故D为KCl,C为KOH,金属Fe与稀盐酸反应会生成FeCl2和气体H2.
解答 解:白色沉淀E在空气中转化为红褐色沉淀F,则E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应得到G,G与单质A反应得到B,结合转化关系及元素守恒可知,A为Fe,G为FeCl3,B为FeCl2,B与C溶液反应得到D,D与AgNO3生成白色沉淀H,可知H为AgCl,透过蓝色钴玻璃观察焰色反应为紫色,可知D溶液中含有K+,故D为KCl,C为KOH,金属Fe与稀盐酸反应会生成FeCl2和气体H2.
(1)由上述分析可知,B为FeCl2,D为KCl,故答案为:FeCl2;KCl;
(2)Fe(OH)2在空气中与O2反应转变为Fe(OH)3,反应为4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)FeCl3溶液中加入铜粉反应的离子方程式:2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+.
点评 本题考查无机物的推断,E到F的颜色变化及焰色反应等时推断突破口,侧重铁及其化合物的性质及转化的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列除去杂质的方法中正确的是( )
| A. | Cl2中混有少量HCl:通过盛有足量硝酸银溶液的洗气瓶洗气 | |
| B. | Cl2中混有少量水蒸气:先通过足量浓硫酸,再用向下排空气法收集氯气 | |
| C. | HCl中混有少量Cl2:通过盛有四氯化碳的洗气瓶洗气 | |
| D. | HCl中混有少量Cl2:通入足量氢气并光照 |
17.下表是25℃时四种酸的电离平衡常数:
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)25℃时,向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5.
(3)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),.
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl与NaNO2与试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法可行(填“可行”或“不可行”),理由是NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行.
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
(2)25℃时,向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5.
(3)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),.
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl与NaNO2与试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法可行(填“可行”或“不可行”),理由是NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行.
14.有Fe2(SO4)3和CuCl2的混合溶液V L将它分成两份.一份滴加氢氧化钠溶液,使Fe3+和Cu2+完全沉淀;另一份滴加Ba(NO3)2溶液,使SO42-完全沉淀.反应中消耗a mol NaOH、b mol Ba(NO3)2.据此得知原混合溶液中c(Cu2+)(单位:mol/L)为( )
| A. | $\frac{2a-4b}{V}$ | B. | $\frac{2(a-b)}{V}$ | C. | $\frac{a-2b}{V}$ | D. | $\frac{2a-b}{V}$ |
3.下列分离方法正确的是( )
| A. | 用溶解后过滤的方法除去CaCl2中的少量的ZnSO4 | |
| B. | 用萃取的方法分离NaCl溶液和汽油 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用蒸馏的方法除去水中的不挥发的杂质 |
20.下列图示的化学实验操作中,正确的是( )
| A. |  倾倒液体 | B. |  取粉末状固体药品 | ||
| C. |  过滤 | D. |  浓硫酸的稀释 |