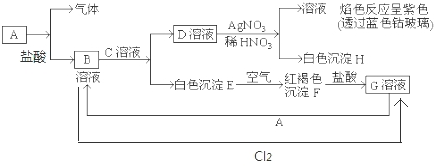
题目内容
5.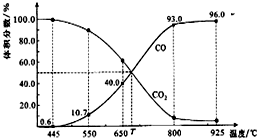 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正,?逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为放热反应 |
分析 A、可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v退均减小,又改反应是气体体积增大的反应,则平衡正向移动;
B、由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
C、由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态;
D.图象分析可知T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,升温一氧化碳浓度增大,二氧化碳浓度减小,平衡正向进行,正反应为吸热反应.
解答 解:A、可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v退均减小,正反应是气体体积增大的反应,则平衡正向移动,故A错误;
B、由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为$\frac{0.25}{1}$×100%=25%,故B正确;
C、由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,T℃时,若充入等体积的CO2和CO平衡不移动,故C错误;
D.图象分析可知T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,此点后,化学反应随升高温度一氧化碳浓度增大,二氧化碳浓度减小,平衡正向进行,升温平衡向吸热反应反应进行,所以正反应为吸热反应,故D错误;
故选B.
点评 本题考查了化学平衡图象、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.

| A. | Cl2中混有少量HCl:通过盛有足量硝酸银溶液的洗气瓶洗气 | |
| B. | Cl2中混有少量水蒸气:先通过足量浓硫酸,再用向下排空气法收集氯气 | |
| C. | HCl中混有少量Cl2:通过盛有四氯化碳的洗气瓶洗气 | |
| D. | HCl中混有少量Cl2:通入足量氢气并光照 |
| A. | 0.5 moL•L-1 | B. | 1.0 moL•L-1 | C. | 1.2 moL•L-1 | D. | 1.5 moL•L-1 |
| A. | 表面附着氨水的碳素钢在空气中主要发生析氢腐蚀 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl (s)的△H<0,△S<0 | |
| C. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH>7 | |
| D. | 向2NH3(g)?N2(g)+3H2(g)的平衡体系中加入催化剂,NH3的平衡转化率增大 |
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
(2)25℃时,向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5.
(3)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(4)25℃时,等物质的量浓度的HA、NaA混合溶液中,各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),.
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl与NaNO2与试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法可行(填“可行”或“不可行”),理由是NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行.
| A. | $\frac{2a-4b}{V}$ | B. | $\frac{2(a-b)}{V}$ | C. | $\frac{a-2b}{V}$ | D. | $\frac{2a-b}{V}$ |
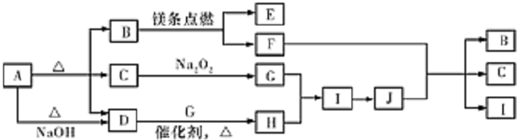
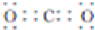 .
.