题目内容
11.下列反应的离子方程式书写正确的是( )| A. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| B. | 铝粉与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| C. | 利用腐蚀法制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 在氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.氢氧化铜在离子反应中保留化学式;
B.漏写氧化剂水;
C.电子、电荷不守恒;
D.反应生成氢氧化铝和氯化铵.
解答 解:A.氢氧化铜与盐酸反应的离子反应为Cu(OH)2+2H+═Cu2++2H2O,故A错误;
B.铝粉与氢氧化钠溶液反应的离子反应为2H2O+2Al+2OH-═2AlO2-+3H2↑,故B错误;
C.利用腐蚀法制作印刷电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.在氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意电子、电荷守恒及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
1.海水总量极大.金,铀等微量元素在海水中的总量自然也大,但从海水中获取这些微量元素的成本很高.其中成本最高的步骤在于( )
| A. | 从海水中富集含微量元素的化合物 | B. | 使含微量元素的离子沉淀 | ||
| C. | 对含微量元素的混合物进行提纯 | D. | 从化合物中冶炼这些单质 |
6.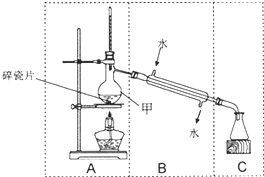 如图装置在中学化学实验中常用于物质的分离与提纯.
如图装置在中学化学实验中常用于物质的分离与提纯.
(1)加入药品之前要检验装置的气密性
(2)仪器甲的名称是蒸馏烧瓶.B中仪器的名称冷凝管
(3)上图存在一处错误,请指出存在错误的区域B(填“A”、“B”或“C”).
(4)图中错误改正后,该装置可完成下列实验中的C(填序号).
 如图装置在中学化学实验中常用于物质的分离与提纯.
如图装置在中学化学实验中常用于物质的分离与提纯.(1)加入药品之前要检验装置的气密性
(2)仪器甲的名称是蒸馏烧瓶.B中仪器的名称冷凝管
(3)上图存在一处错误,请指出存在错误的区域B(填“A”、“B”或“C”).
(4)图中错误改正后,该装置可完成下列实验中的C(填序号).
| A.除去CO2气体中混有的少量HCl气体 |
| B.从硝酸钾和氯化钠的混合物中提纯得到硝酸钾 |
| C.用含有Fe3+的自来水获得少量纯净的水 |
16.下列除去杂质的方法中正确的是( )
| A. | Cl2中混有少量HCl:通过盛有足量硝酸银溶液的洗气瓶洗气 | |
| B. | Cl2中混有少量水蒸气:先通过足量浓硫酸,再用向下排空气法收集氯气 | |
| C. | HCl中混有少量Cl2:通过盛有四氯化碳的洗气瓶洗气 | |
| D. | HCl中混有少量Cl2:通入足量氢气并光照 |
3.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
20.向100mL由等物质的量的FeBr2和FeI2配成的混合溶液中,缓慢通入氯气3.36L(标准状况),反应完全后,溶液中有一半的Fe2+被氧化成Fe3+,则原混合液中FeI2的物质的量浓度为( )
| A. | 0.5 moL•L-1 | B. | 1.0 moL•L-1 | C. | 1.2 moL•L-1 | D. | 1.5 moL•L-1 |
3.下列分离方法正确的是( )
| A. | 用溶解后过滤的方法除去CaCl2中的少量的ZnSO4 | |
| B. | 用萃取的方法分离NaCl溶液和汽油 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用蒸馏的方法除去水中的不挥发的杂质 |