题目内容
14.火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响.对燃煤废气进行脱硝?脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.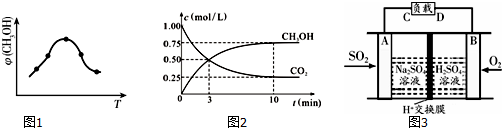
(1)脱硝.
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol则甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol.
(2)脱碳.
将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇的反应热△H3<0(填“>”?“<”或“=”),该反应的平衡常数表达式为K=$\frac{{c(C{H_3}OH)•c({H_2}O)}}{{c(C{O_2})•{c^3}({H_2})}}$.
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图2所示,试回答:
0~10min内,氢气的平均反应速率为0.225mol/(L•min).第10min后,若向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数变大 (填“变大”?“减少”或“不变”).
(3)脱硫.
①有学者想利用如图3所示装置用原电池原理将SO2转化为重要的化工原料.A?B是惰性电极,A极的电极反应式为:SO2-2e-+2H2O=SO42-+4H+.
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥.常温下,将NH4NO3溶解于水中,为了使该溶液中的NH4+和 NO3-离子的物质的量浓度之比等于1:1,可以采取的正确措施为B
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH=7
C.加入适量的 NaOH 溶液,使溶液的PH=7
D.加入适量的NH4NO3.
分析 (1)根据盖斯定律和热化学方程式的意义和书写方法,根据已知方程式(①+②)×$\frac{1}{2}$构建目标方程式,反应热与化学计量数成正比;
(2)①图象分析,甲醇含量随温度变化的曲线特征,开始反应进行,平衡后,升温平衡逆向进行,根据温度对化学平衡移动的影响知识来回答,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②三段式来计算平衡浓度,根据化学反应速率v=$\frac{△c}{△t}$以及平衡常数的表达式计算,0~10min内,二氧化碳的平均反应速率=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/(L•min),反应速率之比等于化学方程式计量数之比,所以氢气的反应速率是3×0.075mol/(L•min)=0.225mol/(L•min),若向该容器中再充入1mol CO2和3mol H2,相当于增大压强,根据压强对化学平衡移动的影响知识来回答;
(3)①SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应;
②硝酸铵是强酸弱碱盐,由于NH4+水解,导致溶液中c(NH4+)<c(NO3-),氢离子浓度大于氢氧根离子浓度,溶液呈酸性;为了配制NH4+与NO3-的浓度比为1:1的溶液,须加一定量的能电离出铵根离子的物质,或减少溶液中NO3-的浓度,据此分析.
解答 解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
由盖斯定律(①+②)×$\frac{1}{2}$得到热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=$\frac{1}{2}$(-574kJ•mol-1-1160kJ•mol-1)=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①根据图象分析知道:温度升高,甲醇的体积分数φ(CH3OH)减小,平衡逆向移动,所以反应是放热的,即△H3<0,CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应的平衡常数表达式 K=$\frac{{c(C{H_3}OH)•c({H_2}O)}}{{c(C{O_2})•{c^3}({H_2})}}$,
故答案为:<;$\frac{{c(C{H_3}OH)•c({H_2}O)}}{{c(C{O_2})•{c^3}({H_2})}}$;
②0~10min内,二氧化碳的平均反应速率=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/(L•min),所以氢气的反应速率是3×0.075mol/(L•min)=0.225mol/(L•min),向该容器中再充入1mol CO2和3mol H2,会使得压强增大,平衡正向移动,所以再次达到平衡时CH3OH(g)的体积分数变大,
故答案为:0.225;变大;
(3)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,则A为负极,A电极发生的反应为:SO2-2e-+2 H2O=4H++SO42-,
故答案为:SO2-2e-+2 H2O=4H++SO42-;
②硝酸铵是强酸弱碱盐,由于NH4+水解,因铵盐要发生水解:NH4++H2O?NH3•H2O+H+,导致溶液中c(NH4+)<c(NO3-).
A.加入硝酸,氢离子的浓度增大能抑制铵根离子的水解,但硝酸中有硝酸根离子导致硝酸根离子的浓度增大,c(NH4+)<c(NO3-),故A错误;
B.加入氨水使溶液的PH=7,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性,溶液中阴阳离子所带的电荷相等,所以c(NH4+):c(NO3-)=l:l,故B正确;
C.加入适量的NaOH,使溶液的pH=7,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性,溶液中阴阳离子所带的电荷相等,[c(NH4+)+C(Na+)]:c(NO3-)=l:l,所以c(NH4+):c(NO3-)小于l:l,故C错误;
D.再加入适量的NH4NO3,不能抑制铵根离子的水解,仍存在c(NH4+):c(NO3-)小于l:l,故D错误;
故答案为:B.
点评 本题考查化学平衡的影响因素、热化学方程式、盐类水解等,培养了学生分析问题解决问题的能力,需要学生具备扎实的基础,注意含弱根离子的盐类水解(弱酸弱碱盐除外)都是较微弱的,盐类在水中以电离为主,题目难度中等.

①液态氧 ②空气 ③Mg ④二氧化碳⑤H2SO4⑥Ca(OH)2⑦CuSO4•5H2O⑧牛奶 ⑨C2H5OH ⑩NaHCO3下列分类正确的是( )
| A. | 属于混合物的是②⑦⑧ | B. | 属于盐的是⑥⑩ | ||
| C. | 属于电解质的是⑤⑥⑦⑩ | D. | 属于分散系的是②⑦⑧⑨ |
| 反应时间/min | n(SO3)/mol | n(O2)/mol |
| 0 | 2.0 | 0 |
| 2 | 0.8 | |
| 4 | 0.6 | |
| 6 | 1.8 | 1.1 |
| A. | 0~2 min平均速率v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 4 min后,平衡移动的原因可能是减压 | |
| C. | 若升高温度后的平衡常数的值为1.0,则该正反应为吸热反应 | |
| D. | 若起始时容器中SO3的物质的量改为1.0 mol,则平衡时n(SO2)=0.6 mol |
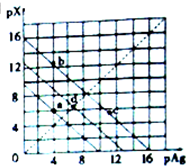 某温度时,卤化银(AgX,X=Cl,Br,I)的3条沉淀溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条沉淀溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),下列说法错误的是( )| A. | 由a点可知该温度下Ksp(AgCl)=l0-10 | |
| B. | 加入AgNO3可使溶液由b点变到c点 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | 坐标点(14,8)形成的溶液是AgI的不饱和溶液 |
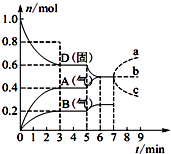 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列叙述不正确的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列叙述不正确的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.066 7 mol/(L•min) | |
| B. | 该反应的化学方程式为2D(s)?2A(g)+B(g),该反应的平衡常数表达式为K=c2(A)•c(B) | |
| C. | 已知反应的△H>0,则第5 min时图象呈现上述变化的原因可能是升高体系的温度 | |
| D. | 若在第7 min时增加D的物质的量,则表示A的物质的量变化正确的是a曲线 |