题目内容
A为短周期元素组成的常见物质,有下列转化关系:
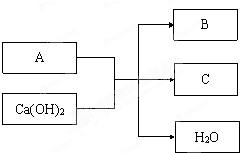
请回答:
(1)若 A为黄绿色气体.
①组成A的元素在周期表中的位置是 .
②下列关于A的说法正确的是 (填字母).
a.常用于自来水的杀菌、消毒
b.与Ca(OH)2反应可制取漂白粉
c.大量泄漏时,迅速离开现场并尽量往高处去
(2)若A为含氯元素的离子化合物,B为能使湿润的红色石蕊试纸变蓝的气体.
①A与Ca(OH)2反应的化学方程式是 .
②若1mol B经一系列反应最终得到1mol HNO3,则该过程中转移电子的物质的量为 mol.

请回答:
(1)若 A为黄绿色气体.
①组成A的元素在周期表中的位置是
②下列关于A的说法正确的是
a.常用于自来水的杀菌、消毒
b.与Ca(OH)2反应可制取漂白粉
c.大量泄漏时,迅速离开现场并尽量往高处去
(2)若A为含氯元素的离子化合物,B为能使湿润的红色石蕊试纸变蓝的气体.
①A与Ca(OH)2反应的化学方程式是
②若1mol B经一系列反应最终得到1mol HNO3,则该过程中转移电子的物质的量为
考点:无机物的推断
专题:
分析:(1)若A为黄绿色气体,则A为Cl2,氯气常用于自来水的杀菌、消毒,与Ca(OH)2反应可制取漂白粉,氯气有毒,其密度比空气大,大量氯气泄漏时,迅速离开现场并尽量往高处去;
(2)若A为含氯元素的离子化合物,B为能使湿润的红色石蕊试纸变蓝的气体,则B为NH3,A为NH4Cl,C为CaCl2.
(2)若A为含氯元素的离子化合物,B为能使湿润的红色石蕊试纸变蓝的气体,则B为NH3,A为NH4Cl,C为CaCl2.
解答:
解:(1)若A为黄绿色气体,则A为Cl2,
①组成A的元素为Cl,处于周期表中第三周期ⅦA族,故答案为:第三周期ⅦA族;
②a.氯气常用于自来水的杀菌、消毒,故a正确;
b.工业上常用氯气与Ca(OH)2反应可制取漂白粉,故b正确;
c.氯气有毒,其密度比空气大,大量氯气泄漏时,迅速离开现场并尽量往高处去,故c正确,
故答案为:abc;
(2)若A为含氯元素的离子化合物,B为能使湿润的红色石蕊试纸变蓝的气体,则B为NH3,A为NH4Cl,C为CaCl2,
①A与Ca(OH)2反应的化学方程式是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
②若1mol NH3经一系列反应最终得到1mol HNO3,N元素化合价由-3升高为+5,则该过程中转移电子的物质的量为1mol×[5-(-3)]=8mol,故答案为:8.
①组成A的元素为Cl,处于周期表中第三周期ⅦA族,故答案为:第三周期ⅦA族;
②a.氯气常用于自来水的杀菌、消毒,故a正确;
b.工业上常用氯气与Ca(OH)2反应可制取漂白粉,故b正确;
c.氯气有毒,其密度比空气大,大量氯气泄漏时,迅速离开现场并尽量往高处去,故c正确,
故答案为:abc;
(2)若A为含氯元素的离子化合物,B为能使湿润的红色石蕊试纸变蓝的气体,则B为NH3,A为NH4Cl,C为CaCl2,
①A与Ca(OH)2反应的化学方程式是:2NH4Cl+Ca(OH)2
| ||
| ||
②若1mol NH3经一系列反应最终得到1mol HNO3,N元素化合价由-3升高为+5,则该过程中转移电子的物质的量为1mol×[5-(-3)]=8mol,故答案为:8.
点评:本题考查无机物推断,难度不大,需要学生熟练掌握元素化合物性质.

练习册系列答案
相关题目
在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
| A、Ca2+、Na+、NO3-、CO32- |
| B、Mg2+、Cl-、NH4+、SO42- |
| C、K+、Cl-、HCO3-、NO3- |
| D、Ca2+、Na+、Fe3+、NO3- |
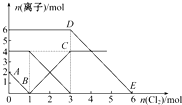 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、线段AB表示Fe2+被氯气氧化 |
| C、线段BC表示生成4 mol Fe3+ |
| D、原溶液中n(Br-)=6 mol |
可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是:( )
①一个N≡N键断裂的同时,有3个H-H键断裂
②其它条件不变时,混合气体平均式量不再改变
③保持其它条件不变时,体系压强不再改变
④恒温恒容时,密度保持不变
⑤NH3%不再改变
⑥2υ正(H2)=3υ逆(NH3)
⑦容器内三种气体共存
⑧N2、H2、NH3分子式之比为1:3:2.
①一个N≡N键断裂的同时,有3个H-H键断裂
②其它条件不变时,混合气体平均式量不再改变
③保持其它条件不变时,体系压强不再改变
④恒温恒容时,密度保持不变
⑤NH3%不再改变
⑥2υ正(H2)=3υ逆(NH3)
⑦容器内三种气体共存
⑧N2、H2、NH3分子式之比为1:3:2.
| A、全部 | B、只有①③⑤ |
| C、②③⑤⑥ | D、只有③⑤⑥ |
在恒温时,一固定容积的容器内发生如下反应:2NO2(g)?N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
| A、不变 | B、增大 |
| C、减小 | D、无法判断 |
下列反应中氯元素全部被还原的是( )
| A、5Cl2+I2+6H2O=10HCl+2HIO3 |
| B、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
| C、MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑ |
| D、2NaCl+2H2O=2NaOH+Cl2↑+H2↑ |
