题目内容
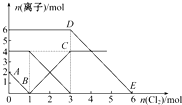 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、线段AB表示Fe2+被氯气氧化 |
| C、线段BC表示生成4 mol Fe3+ |
| D、原溶液中n(Br-)=6 mol |
考点:有关混合物反应的计算
专题:计算题
分析:氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,根据反应可知,还原性强弱为:I->Fe2+>Br-;
氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,
在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,
通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,
在通入氯气的量为3~6mol的过程中,溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,
据此回答判断.
氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,
在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,
通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,
在通入氯气的量为3~6mol的过程中,溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,
据此回答判断.
解答:
解:A、反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性:I->Fe2+>Br-,故A正确;
B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,AB段表示的是碘离子的物质的量,故B错误;
C、通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,所以含有亚铁离子共4mol,反应后BC段生成4mol铁离子,故C正确;
D、在通入氯气的量为3~6mol的过程中,溴离子从6ml降到0,所以溴离子的物质的量是:n(Br-)=6mol,故D正确;
故选B.
B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,AB段表示的是碘离子的物质的量,故B错误;
C、通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,所以含有亚铁离子共4mol,反应后BC段生成4mol铁离子,故C正确;
D、在通入氯气的量为3~6mol的过程中,溴离子从6ml降到0,所以溴离子的物质的量是:n(Br-)=6mol,故D正确;
故选B.
点评:本题考查混合物反应的计算,题目难度中等,侧重考查氧化还原反应中氧化性和还原性强弱的知识,试题综合性较强,正确判断I-、Fe2+、Br-的还原性强弱及图象中曲线变化的含义为解答本题关键.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)?Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
| A、2v正(X)=v逆(Y) |
| B、单位时间内生成1 mol Y的同时生成2 mol X |
| C、混合气体的密度不再变化 |
| D、反应容器中Y的质量分数不变 |
一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断不正确的是( )
| A、c1:c2=1:3 |
| B、该反应一定是朝正向反应建立平衡 |
| C、X、Y的转化率相等 |
| D、c1的取值范围为0<c1<0.14 mol/L |
 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、3:1 | D、6:1 |
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如表所示.下列说法正确的是( )
| 时间 | 起始 | 5min | 10min | 15min | 20min | 25min | 30min |
| A浓度(mol?L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
| B浓度(mol?L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
| D浓度(mol?L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
| A、反应在前10min的平均反应速率v(D)=0.3mol?L-1?min-1 | ||
B、该反应的平衡常数表达式K=
| ||
| C、若平衡时保持温度不变,压缩容器体积平衡不移动 | ||
| D、反应至15min时,改变的条件可以是升高温度 |