题目内容
在恒温时,一固定容积的容器内发生如下反应:2NO2(g)?N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
| A、不变 | B、增大 |
| C、减小 | D、无法判断 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:假设再次通入的NO2是在与原平衡体系的温度和压强都相同的另一容器中进行,则所得平衡体系与原平衡完全相同,将两个容器的隔板抽去,再压缩到原体积,平衡正向移动,以此解答.
解答:
解:假设在题给的过程中,容器的体积从A变化到A+B(见图)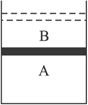 ,这个过程也可以理解成:假设有一个虚拟的隔板可以保持A的体积不变,在B中充入NO2,使其反应直至达到平衡.很明显,在同温、同压下,A、B中达到平衡后,NO2、N2O4的质量分数分别相等.这时,抽去虚拟的隔板,将B压缩至A,平衡正向移动,NO2的体积分数减小.
,这个过程也可以理解成:假设有一个虚拟的隔板可以保持A的体积不变,在B中充入NO2,使其反应直至达到平衡.很明显,在同温、同压下,A、B中达到平衡后,NO2、N2O4的质量分数分别相等.这时,抽去虚拟的隔板,将B压缩至A,平衡正向移动,NO2的体积分数减小.
故选C.
 ,这个过程也可以理解成:假设有一个虚拟的隔板可以保持A的体积不变,在B中充入NO2,使其反应直至达到平衡.很明显,在同温、同压下,A、B中达到平衡后,NO2、N2O4的质量分数分别相等.这时,抽去虚拟的隔板,将B压缩至A,平衡正向移动,NO2的体积分数减小.
,这个过程也可以理解成:假设有一个虚拟的隔板可以保持A的体积不变,在B中充入NO2,使其反应直至达到平衡.很明显,在同温、同压下,A、B中达到平衡后,NO2、N2O4的质量分数分别相等.这时,抽去虚拟的隔板,将B压缩至A,平衡正向移动,NO2的体积分数减小. 故选C.
点评:本题考查化学平衡的移动,题目难度不大,注意从压强的角度认识该题,题给的关键是反应物和生成物只有一种,易错点为B,注意体会该题.

练习册系列答案
相关题目
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如表所示.下列说法正确的是( )
| 时间 | 起始 | 5min | 10min | 15min | 20min | 25min | 30min |
| A浓度(mol?L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
| B浓度(mol?L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
| D浓度(mol?L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
| A、反应在前10min的平均反应速率v(D)=0.3mol?L-1?min-1 | ||
B、该反应的平衡常数表达式K=
| ||
| C、若平衡时保持温度不变,压缩容器体积平衡不移动 | ||
| D、反应至15min时,改变的条件可以是升高温度 |
下列分离或提纯物质的方法错误的是( )
| 选项 | 物质 | 混有的少量杂质量质质 | 试剂及主要操作 |
| A | 溴苯 | 溴 | 加入苯酚后过滤 |
| B | 硝基苯 | CaCl2 | 蒸馏 |
| C | 乙酸乙酯 | 乙酸 | 加饱和碳酸钠溶液后分液 |
| D | CO2 | CO | 通过灼热的氧化铜 |
| A、A | B、B | C、C | D、D |
室温时将PH=5的硫酸溶液稀释1000倍后,则c(H+):c(SO42-)是( )
| A、2:1 | B、21:1 |
| C、20:1 | D、22:1 |
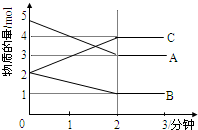 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是