题目内容
17.某原电池装置示意图如图所示.下列关于该原电池的说法正确的是( )
| A. | 锌片发生还原反应 | |
| B. | 该装置将电能转化为化学能 | |
| C. | 电子由铁电极经导线流向锌电极 | |
| D. | 如果将锌片换成铜片,电路中的电流方向将会改变 |
分析 该装置是原电池,Zn易失电子作负极、Fe作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,放电时,电子从负极沿导线流向正极,电流与此相反.
解答 解:A.Zn易失电子作负极、Fe作正极,故A错误;
B.该装置为原电池,将化学能转化为电能,故B错误;
C.电子从锌电极沿导线流向铁电极,故C错误;
D.Zn作负极、Fe作正极时,电流从Fe沿导线流向Zn,如果将锌片互称Cu,Fe是负极、Cu是正极,则电流从Cu流向Fe,所以电路中的电流方向将会改变,故D正确.
故选:D.
点评 本题考查了原电池原理,明确正负极的判断方法、电子流向、电极反应式的书写即可解答,易错点是判断电解质溶液中阴阳离子移动方向.

练习册系列答案
相关题目
7.相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)?3W(g)+2Z(g)△H=-Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
| X | Y | W | Z | 反应体系能量变化 | |
| 甲 | 2mol | 1mol | 放出a kJ/mol | ||
| 乙 | 1mol | 1mol | 放出b kJ/mol | ||
| 丙 | 2mol | 2mol | 放出c kJ/mol | ||
| 丁 | 3mol | 2mol | 吸收d kJ/mol |
| A. | 平衡时丙容器中Z的物质的量浓度最大 | |
| B. | c+d<Q | |
| C. | 平衡时,甲容器中的反应速率比丁容器中的慢 | |
| D. | X的转化率为:甲<乙<丙 |
8.下列有关氯元素的说法中,正确的是( )
| A. | 最高正化合价为+7 | B. | Cl2中含有极性共价键 | ||
| C. | HClO4比H2SO4酸性弱 | D. | Cl是卤素中原子半径最小的 |
12.下列物质属于共价化合物的是( )
| A. | NH4Cl | B. | H2SO4 | C. | I2 | D. | NaCl |
2.下列各组排列顺序不正确的是( )
| A. | 原子半径:钠>硫>氯 | B. | 氧化性:Na+>K+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 酸性:HF>HCl>HBr |
6.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 | |
| D. | 某有机物的结构简式为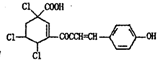 ,1mol该有机物通过消去反应脱去1 molHCl时,能得到5种不间产物(不考虑立体异构) ,1mol该有机物通过消去反应脱去1 molHCl时,能得到5种不间产物(不考虑立体异构) |
7.氨的合成是一项重要的化工生产.已知合成氨有关能量变化的图象如图1.

(1)反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-92KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
则表中X的值是391.
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是加入催化剂.

(1)反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-92KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | X | 946 |
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是加入催化剂.
 C:CH3CH2OH
C:CH3CH2OH .
. +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. +(2n-1)H2O.
+(2n-1)H2O.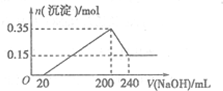 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.