题目内容
16.下列解释事实的方程式不正确的是( )| A. | 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2═2Na2O | |
| B. | 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液混合,产生气体:NH4++OH-═NH3↑十+H2O | |
| D. | 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-═Ag2S↓+2I- |
分析 A.钠在空气中与氧气缓慢氧化生成氧化钠;
B.铝表面被氧化成氧化铝,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
C.漏掉了钡离子与硫酸根离子生成硫酸钡的反应;
D.硫化银更难溶,实现了沉淀的转化.
解答 解:A.金属钠露置在空气中发生反应:4Na+O2═2Na2O,导致光亮表面颜色变暗,故A正确;
B.铝条插入烧碱溶液中,开始时发生反应:Al2O3+2OH-═2AlO2-+H2O,所以开始没有明显现象,故B正确;
C.硫酸铵溶液与氢氧化钡溶液混合,二者还生成硫酸钡沉淀,正确的离子方程式为:SO42-+Ba2++2NH4++2OH-═NH3↑十+H2O+BaSO4↓,故C错误;
D.碘化银悬浊液滴加硫化钠溶液,碘化银转化成硫化银沉淀,则黄色沉淀变成黑色,反应的离子方程式为:2AgI+S2-═Ag2S↓+2I-,故D正确;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
16.根据所学知识,判断下列叙述中正确的是( )
| A. | 足量稀硫酸与少量锌反应,滴加少量 CuSO4 溶液,加快了反应速率,不影响 H2总量 | |
| B. | 足量的锌和少量稀硫酸反应,加入醋酸钠溶液降低反应速率,减少了生成的 H2总量 | |
| C. | 2-甲基丙烷光照下与氯气反应,得到 3 种一氯代物 | |
| D. | 仅用水就能鉴别酒精和己烷 |
7.用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是( )
| A. | 相同状况下两电极上产生的气体体积之比为2:1 | |
| B. | 两电极上产生的气体质量之比为8:1 | |
| C. | 相同状况下两电极上产生的气体体积之比为4:1 | |
| D. | 若两电极上产生的气体质量比为16:3,则D2O与H2O的物质的量之比为2:1 |
1.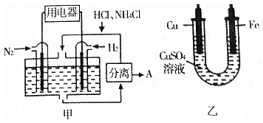 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
下列说法中正确的是( )
 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.下列说法中正确的是( )
| A. | 通入H2-极与图乙中的铜电极相连 | |
| B. | 电池工作一段时间后,溶液pH减少1 | |
| C. | 当消耗0.025molN2时,则铁电极增重1.6g | |
| D. | 通入N2-端的电极反应式为:N2+8H++6e-═2NH4+ |
8.不同实验需要使用不同的酸,以下情况中酸的使用合理的是( )
| A. | 焰色反应前用硫酸洗涤铂丝 | |
| B. | 用硫酸干燥Cl2、HCl、CO2、H2 | |
| C. | 用盐酸酸化KMnO4溶液滴入FeSO4溶液,证明Fe2+具有还原性 | |
| D. | 先加硝酸酸化,再加BaCl2溶液检验未知溶液中的SO42-离子 |
5.下列实验装置或操作设计正确、且能达到目的是( )
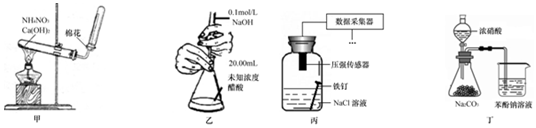

| A. | 用甲装置制取氨气 | |
| B. | 用乙装置测定醋酸浓度 | |
| C. | 用丙装置采集到的压强数据判断铁钉发生电化学腐蚀类型 | |
| D. | 用丁装置验证酸性:硝酸>碳酸>苯酚 |
10.(1)在同一个原子中,离核越近、n越小的能层中的电子能量越低.理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和3d.现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做基态原子.
(2)写出下列基态原子的简化电子排布式:
①14Si1s22s22p63s23p2 或[Ne]3s23p2;②26Fe1s22s22p63s23p63d64s2或[Ar]3d64s2 .
(3)按所示格式填写表中的空格:
(4)N≡N的键能为942kJ•mol-1,N-N单键的键能为247kJ•mol-1,计算说明N2中的π键更稳定(填“σ”或“π”).
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是Fe3+,配离子[Cu(NH3)4]2+的配体是NH3.
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为3,孤电子对数为1,价层电子对数为4,中心原子的杂化方式为sp3杂化,VSEPR构型为四面体形,分子的立体构型为三角锥形.
②BF3分子中,中心原子的杂化方式为sp2杂化,分子的立体构型为平面(正)三角形.
(2)写出下列基态原子的简化电子排布式:
①14Si1s22s22p63s23p2 或[Ne]3s23p2;②26Fe1s22s22p63s23p63d64s2或[Ar]3d64s2 .
(3)按所示格式填写表中的空格:
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是Fe3+,配离子[Cu(NH3)4]2+的配体是NH3.
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为3,孤电子对数为1,价层电子对数为4,中心原子的杂化方式为sp3杂化,VSEPR构型为四面体形,分子的立体构型为三角锥形.
②BF3分子中,中心原子的杂化方式为sp2杂化,分子的立体构型为平面(正)三角形.
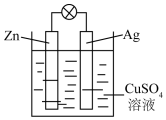 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.