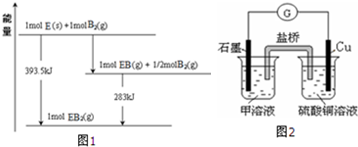
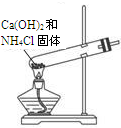
题目内容
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液的pH如下表:
下列判断不正确的是( )
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ①②③ | 0.1 | 0.1 | pH=9 |
| C | 0.2 | pH=7 | |
| 0.2 | 0.1 | pH<7 |
| A、HA的电离方程式为:HA?H++A- |
| B、不考虑其他组的实验结果,c≥0.2 |
| C、③组实验中,混合溶液中c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) |
| D、①组实验中,混合溶液中c(A-)=(0.1+10-9-10-5)mol/L |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据①可以判断HA为弱电解质,存在电离平衡,然后判断其电离方程式是否正确;
B.若HA为强电解质,则c=0.2时溶液显示中性;若HA为弱电解质,则当c=0.2时,溶液显示碱性,如果满足溶液的pH=7,则需要加入稍过量的酸,则c>0.2;
C.一元酸HA和NaOH溶液等体积混合,二者反应后的溶液为等浓度的HA和NaA,溶液pH<7,显酸性,则c(OH-)<c(H+),说明HA的电离大于A-的水解,据此分析判断;
D.溶液①中钠离子浓度减半,为0.05mol/L,根据溶液①中的电荷守恒计算出c(A-).
B.若HA为强电解质,则c=0.2时溶液显示中性;若HA为弱电解质,则当c=0.2时,溶液显示碱性,如果满足溶液的pH=7,则需要加入稍过量的酸,则c>0.2;
C.一元酸HA和NaOH溶液等体积混合,二者反应后的溶液为等浓度的HA和NaA,溶液pH<7,显酸性,则c(OH-)<c(H+),说明HA的电离大于A-的水解,据此分析判断;
D.溶液①中钠离子浓度减半,为0.05mol/L,根据溶液①中的电荷守恒计算出c(A-).
解答:
解:A.由表中①组数据可知,一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应得到pH=9的NaA溶液,c(H+)=10-9mol/L,说明HA为弱电解质,HA的电离方程式为:HA?H++A-,故A正确;
B.当HA为强电解质时,c=0.2,则两溶液混合后溶液显示中性;当HA为弱电解质时,c=0.2时,溶液显示碱性,如果满足溶液的pH=7,则需要加入稍过量的酸,则c>0.2,所以c≥0.2,故B正确;
C.一元酸HA浓度0.2mol/L与0.1mol/LNaOH溶液等体积混合,二者反应后得到等浓度的HA和NaA混合溶液,溶液pH<7,显酸性说明HA的电离大于A-的水解,则c(OH-)<c(H+),c(A-)>c(Na+)>c(HA),所以溶液中离子浓度为c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故C正确;
D.①的混合液中一定满足电荷守恒:c(OH-)+c(A-)=c(Na+)+c(H+),混合液中钠离子浓度为0.05mol/l,则c(A-)=c(Na+)+c(H+)-c(OH-)=(0.05+10-9-10-5)mol/L,故D错误;
故选D.
B.当HA为强电解质时,c=0.2,则两溶液混合后溶液显示中性;当HA为弱电解质时,c=0.2时,溶液显示碱性,如果满足溶液的pH=7,则需要加入稍过量的酸,则c>0.2,所以c≥0.2,故B正确;
C.一元酸HA浓度0.2mol/L与0.1mol/LNaOH溶液等体积混合,二者反应后得到等浓度的HA和NaA混合溶液,溶液pH<7,显酸性说明HA的电离大于A-的水解,则c(OH-)<c(H+),c(A-)>c(Na+)>c(HA),所以溶液中离子浓度为c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故C正确;
D.①的混合液中一定满足电荷守恒:c(OH-)+c(A-)=c(Na+)+c(H+),混合液中钠离子浓度为0.05mol/l,则c(A-)=c(Na+)+c(H+)-c(OH-)=(0.05+10-9-10-5)mol/L,故D错误;
故选D.
点评:本题考查离子浓度大小比较、溶液PH值飞计算、盐类水解应用等知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、盐的水解、物料守恒比较溶液中离子浓度大小,选项BD为易错点,注意B中题干信息,明确D中钠离子浓度减半.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式表达正确的是( )
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、向H2O中投入少量Na218O2固体:2H2O+2Na218O2═4Na++418 OH-+O2↑ |
| D、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
现有X、Y、Z三种常见短周期元素,Y、Z为同周期金属元素,且X和Y的某种化合物为淡黄色固体M,Y、Z的最高价氧化物对应的水化物可以反应生成盐N和水.下列说法不正确的是( )
| A、固体M能与水反应生成X单质和一种强碱 |
| B、Z单质的薄片在酒精灯上加热能熔化,但不滴落 |
| C、Y的最高价氧化物对应的水化物和盐N均能抑制水的电离 |
| D、M和N中均含有离子键和共价键 |
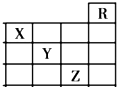 如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z
③Z的单质常温下是液体,一定条件下可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A、只有③ | B、只有①④ |
| C、只有①②③④ | D、①②③④⑤ |
有机化合物A转化为B的反应如下,下列说法正确的是( )


| A、B的分子式为C16H14O2 |
| B、上述转化属于还原反应 |
| C、二者均为芳香烃 |
| D、二者均能发生加成、酯化反应 |
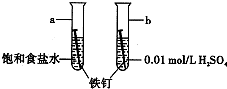 如图是研究铁钉腐蚀的装置图.下列说法不正确的是( )
如图是研究铁钉腐蚀的装置图.下列说法不正确的是( )| A、ab在两处的腐蚀速率a<b |
| B、a、b两处铁钉中的碳均为正极 |
| C、a、b两处铁钉中的铁均失电子被氧化 |
| D、a、b两处的正极反应式均为O2+4e-+4H+═2H2O |
以氧化铝为原料制取氢氧化铝,最好的方法是( )
| A、将氧化铝溶于水 |
| B、将氧化铝先溶于盐酸中,之后滴加氨水 |
| C、将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液 |
| D、将氧化铝溶于氢氧化钾 |