题目内容
下列离子方程式表达正确的是( )
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、向H2O中投入少量Na218O2固体:2H2O+2Na218O2═4Na++418 OH-+O2↑ |
| D、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.二者反应生成氢氧化铝和碳酸氢钠;
B.要使SO42-恰好反应完全,则NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,二者反应生成硫酸钡、一水合氨和氢氧化铝沉淀;
C.该反应过氧化钠中O元素得失电子后存在于OH-、O2;
D.酸性条件下不能生成OH-.
B.要使SO42-恰好反应完全,则NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,二者反应生成硫酸钡、一水合氨和氢氧化铝沉淀;
C.该反应过氧化钠中O元素得失电子后存在于OH-、O2;
D.酸性条件下不能生成OH-.
解答:
解:A.二者反应生成氢氧化铝和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故A正确;
B.要使SO42-恰好反应完全,则NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,离子方程式为NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3+NH3?H2O+2BaSO4,故B错误;
C.该反应过氧化钠中O元素得失电子后存在于OH-、O2,离子方程式为2H2O+2Na218O2═4Na++218 OH-+2OH-+O2↑,故C错误;
D.酸性条件下不能生成OH-,离子方程式为2H++2I-+H2O2═I2+2H2O,故D错误;
故选A.
B.要使SO42-恰好反应完全,则NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,离子方程式为NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3+NH3?H2O+2BaSO4,故B错误;
C.该反应过氧化钠中O元素得失电子后存在于OH-、O2,离子方程式为2H2O+2Na218O2═4Na++218 OH-+2OH-+O2↑,故C错误;
D.酸性条件下不能生成OH-,离子方程式为2H++2I-+H2O2═I2+2H2O,故D错误;
故选A.
点评:本题考查了离子方程式的书写,明确反应实质是解本题关键,注意AB中反应方程式与反应物的量有关,知道离子反应先后顺序,难点是C选项过氧化钠中O元素存在于哪些生成物中,题目难度中等.

练习册系列答案
相关题目
用如图实验装置进行相应实验,装置正确且能达到实验目的是( )
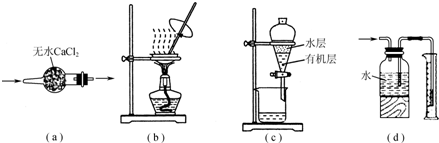

| A、用图a所示装置干燥SO2气体 |
| B、用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体 |
| C、用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 |
| D、用图d所示装置测量氨气的体积 |
以下物质的提纯方法错误的是(括号内为杂质)( )
| A、CO2(H2S):通过CuSO4溶液 |
| B、CH3COOH(H2O):加新制生石灰,蒸馏 |
| C、苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液 |
| D、MgCl2溶液(Fe3+):加MgO,过滤 |
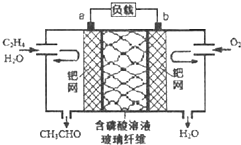 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、每有0.1mol O2反应,则迁移H+0.4mol |
| C、正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O |
| D、电子移动方向:电极a→磷酸溶液→电极b |
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA |
| B、标准状况下,44.8L NO与22.4L O2混合后气体中分子总数等于2NA |
| C、1mol Fe在氧气中充分燃烧失去3NA个电子 |
| D、NO2和H2O反应每生成2mol HNO3时转移的电子数目为2NA |
以下情况都有气体产生,其中不产生红棕色气体的是( )
| A、加热浓硝酸 |
| B、光照硝酸银 |
| C、加热硝酸钙 |
| D、加热溴化钾和浓硫酸混合物 |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液的pH如下表:
下列判断不正确的是( )
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ①②③ | 0.1 | 0.1 | pH=9 |
| C | 0.2 | pH=7 | |
| 0.2 | 0.1 | pH<7 |
| A、HA的电离方程式为:HA?H++A- |
| B、不考虑其他组的实验结果,c≥0.2 |
| C、③组实验中,混合溶液中c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) |
| D、①组实验中,混合溶液中c(A-)=(0.1+10-9-10-5)mol/L |