题目内容
实验室在配制Fe2(SO4)3水溶液时,先把Fe2(SO4)3晶体溶解在较浓H2SO4中,再加水稀释至所需浓度,如此操作的目的是( )
| A、防止硫酸铁分解 |
| B、抑制Fe2(SO4)3水解 |
| C、提高硫酸铁的溶解度 |
| D、提高溶液的pH |
考点:影响盐类水解程度的主要因素
专题:盐类的水解专题
分析:实验室在配制硫酸铁溶液时,铁离子水解生成氢氧化铁变浑浊,先把硫酸铁晶体溶解在较浓的硫酸中,硫酸抑制铁离子的水解,再加水稀释至所需浓度.
解答:
解:因为铁离子会水解,生成氢氧化铁,Fe3++3H2O?Fe(OH)3+3H+;加入硫酸的目的是在溶液里面形成一种酸性条件,抑制氢氧化铁的生成,使得所配的溶液不会有沉淀,得到较纯净的硫酸铁溶液,
故选B.
故选B.
点评:本题考查了盐类水解的应用,把握水解平衡的影响因素是解题关键,题目较简单.

练习册系列答案
相关题目
阿伏加德罗常数为NA,下列说法中正确的是( )
| A、1.0L 1.0 mol?L-1NaNO3溶液中含有的氧原子数为3NA |
| B、在标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA |
C、 31 g P4 (分子结构如图)中含有的P-P键个数为1.5NA 31 g P4 (分子结构如图)中含有的P-P键个数为1.5NA |
| D、0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA |
橙花醛是一种香料,结构简式为:(CH3)2C═CHCH2CH2C(CH3)═CHCHO.下列说法不正确的是( )
| A、橙花醛可使溴水和酸性高锰酸钾溶液退色 |
| B、橙花醛可以发生银镜反应 |
| C、1mol橙花醛最多可以与3mol氢气发生加成反应 |
| D、橙花醛是丙烯醛的同系物 |
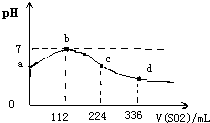 标准状况下,向100mlH2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mlH2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )| A、原H2S溶液的物质的量浓度为0.05mol/L |
| B、氢硫酸的酸性比亚硫酸的酸性强 |
| C、b点水的电离程度比c点水的电离程度大 |
| D、a点对应溶液的导电性比d点强 |
在标准状况下,一个盛满空气的容器重95.3g(已知空气的平均相对分子质量为29.0),在相同条件下若改盛满SO2气体时重98.8g,则此容器的体积约是( )
| A、0.560L |
| B、1.12L |
| C、2.24L |
| D、3.36L |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1L 0.1 mol?L-1的H2SO4溶液中粒子数为0.15NA |
| B、标准状况下,22.4L乙醇中含有的氧原子数为NA |
| C、1mol CO2分子中共用电子对数为2NA |
| D、23g Na与足量的O2完全反应,失去的电子数目为NA |
短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
| A、若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B、若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| C、若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| D、若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |