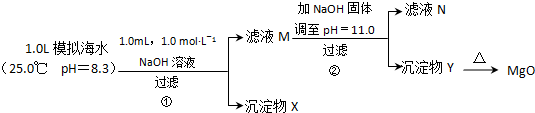
题目内容
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、15 mL |
考点:化学方程式的有关计算
专题:计算题
分析:NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.Cu失去的电子都被O2得到了,根据电子得失守恒,求出参加反应的铜,然后求出 Cu(NO3)2,再根据 Cu(NO3)2与NaOH 反应的关系,求出NaOH 的物质的量,最终求出NaOH溶液的体积.
解答:
解:NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒:n(Cu)×2=n(O2)×4
n(Cu)×2=
mol×4
解得:n(Cu)=0.15mol 所以 Cu(NO3)2 为0.15mol,
根据 Cu2+~2OH-
0.15mol n(OH-)
则NaOH 为 0.15mol×2=0.3 mol,
则NaOH 体积V=
=
=0.06L,即60ml,
故选:A.
n(Cu)×2=
| 1.68 |
| 22.4 |
解得:n(Cu)=0.15mol 所以 Cu(NO3)2 为0.15mol,
根据 Cu2+~2OH-
0.15mol n(OH-)
则NaOH 为 0.15mol×2=0.3 mol,
则NaOH 体积V=
| n |
| c |
| 0.3mol |
| 5mol/L |
故选:A.
点评:本题主要考查了金属与硝酸反应的计算,若根据化学方程式来计算,无从下手,若根据氧化还原反应中电子得失守恒则化繁为简,平时需注意守恒思想的应用.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
下列物质所含的微粒中,除水分子外,不存在其它分子的是( )
| A、18.4mol?L-1硫酸 |
| B、小苏打溶液 |
| C、氯化钠溶液 |
| D、新制氯水 |
实验室在配制Fe2(SO4)3水溶液时,先把Fe2(SO4)3晶体溶解在较浓H2SO4中,再加水稀释至所需浓度,如此操作的目的是( )
| A、防止硫酸铁分解 |
| B、抑制Fe2(SO4)3水解 |
| C、提高硫酸铁的溶解度 |
| D、提高溶液的pH |
已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol?L-1Na2A溶液pH=6,则下列说法正确的是( )
| A、H2A在水溶液中的电离方程式为:H2A?H++HA-,HA-?H++A2- |
| B、(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-) |
| C、0.0lmol?L-l的H2A溶液pH=2 |
| D、等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多 |
短周期元素W、X、Y、Z的原子序数依次增大,W与Y,X与Z分别位于同一主族,W与X可形成两种常见气体WX2和WX,Y原子的内层电子总数是其最外层电子数的2.5倍,下列叙述中不正确的是( )
| A、WX2分子中所有原子最外层都已满足8电子结构 |
| B、WX2、ZX2的化学键类型相同 |
| C、原子半径大小顺序为:X<W<Y<Z |
| D、乙醇、乙酸、葡萄糖、油脂中均含W、X两种元素 |
 常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )| A、HA为弱酸,MOH为强碱 |
| B、pH=7时,HA与MOH恰好完全反应 |
| C、在N点,c(A-)═c(M+)+c(MOH) |
| D、在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
对于醋酸溶液的下列说法中,不正确的是( )
| A、醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) |
| B、醋酸溶液中加入少量醋酸钠晶体,醋酸电离程度减小 |
| C、0.1mol/L的醋酸溶液中加水稀释,溶液中c(OH-)减小 |
| D、常温下,pH=3的醋酸溶液与pH=11的烧碱溶液等体积混合后,溶液中c(H+)<c(OH-) |
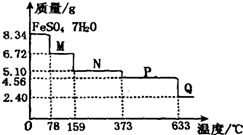 取8.34g FeS04?7H20样品加热,其受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则下列叙述中不正确的是( )
取8.34g FeS04?7H20样品加热,其受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则下列叙述中不正确的是( )| A、温度为78℃时固体物质M的化学式为FeSO4?4H2O | ||||
| B、温度为l59℃时固体物质N的化学式为FeSO4?H2O | ||||
C、在隔绝空气条件下,N得到P的化学方程式为:FeSO4
| ||||
| D、固体P隔绝空气加热至650℃,得到一种固体物质Q,同时有三种无色气体生成,Q的化学式为Fe2O3 |