题目内容
短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
| A、若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B、若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| C、若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| D、若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y可以形成化合物XY2,X可能为IIA、ⅣA族元素,Y可能为ⅤⅡA、ⅥA族元素,即XY2可能为CO2、SO2、SiO2、MgCl2等,还可能为CS2、NO2等,以此来解答.
解答:
解:A.XY2是共价化合物,若为NO2,则X与Y的原子序数可能相差1,故A正确;
B.X与Y的原子序数相差5,若离子化合物XY2为MgCl2,阳离子2个电子层,阴离子为3个电子层,则中X的离子半径比Y离子半径小,故B正确;
C.XY2是离子化合物,为MgCl2、MgF2等,则X与Y的原子序数可能相差5或3,故C错误;
D.X与Y的原子序数相差6,则共价化合物XY2为SiO2,可溶于强碱溶液,故D正确;
故选C.
B.X与Y的原子序数相差5,若离子化合物XY2为MgCl2,阳离子2个电子层,阴离子为3个电子层,则中X的离子半径比Y离子半径小,故B正确;
C.XY2是离子化合物,为MgCl2、MgF2等,则X与Y的原子序数可能相差5或3,故C错误;
D.X与Y的原子序数相差6,则共价化合物XY2为SiO2,可溶于强碱溶液,故D正确;
故选C.
点评:本题考查周期表的结构及应用,为高频考点,把握元素的位置、原子个数与化学式的关系推断化合物XY2为解答的关键,侧重分析及推断能力的考查,注意常见的化合物及应用,题目难度不大.

练习册系列答案
相关题目
下列实验方法或操作正确的是( )
A、 转移溶液 |
B、 制蒸馏水 |
C、 分离水合酒精 |
D、 稀释浓硫酸 |
不能用排水收集法收集的气体是( )
| A、氨气 | B、氧气 |
| C、二氧化硫 | D、一氧化氮 |
实验室在配制Fe2(SO4)3水溶液时,先把Fe2(SO4)3晶体溶解在较浓H2SO4中,再加水稀释至所需浓度,如此操作的目的是( )
| A、防止硫酸铁分解 |
| B、抑制Fe2(SO4)3水解 |
| C、提高硫酸铁的溶解度 |
| D、提高溶液的pH |
已知2SO2+O2?2SO3为放热反应,对该反应的下列说法正确的是( )
| A、O2的能量一定高于SO2的能量 |
| B、2molSO2和1molO2的总能量一定高于2molSO3的总能量 |
| C、SO2的能量一定高于SO3的能量 |
| D、因该反应为放热反应,故不必加热就可发生 |
已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol?L-1Na2A溶液pH=6,则下列说法正确的是( )
| A、H2A在水溶液中的电离方程式为:H2A?H++HA-,HA-?H++A2- |
| B、(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-) |
| C、0.0lmol?L-l的H2A溶液pH=2 |
| D、等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多 |
短周期元素W、X、Y、Z的原子序数依次增大,W与Y,X与Z分别位于同一主族,W与X可形成两种常见气体WX2和WX,Y原子的内层电子总数是其最外层电子数的2.5倍,下列叙述中不正确的是( )
| A、WX2分子中所有原子最外层都已满足8电子结构 |
| B、WX2、ZX2的化学键类型相同 |
| C、原子半径大小顺序为:X<W<Y<Z |
| D、乙醇、乙酸、葡萄糖、油脂中均含W、X两种元素 |
对于醋酸溶液的下列说法中,不正确的是( )
| A、醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) |
| B、醋酸溶液中加入少量醋酸钠晶体,醋酸电离程度减小 |
| C、0.1mol/L的醋酸溶液中加水稀释,溶液中c(OH-)减小 |
| D、常温下,pH=3的醋酸溶液与pH=11的烧碱溶液等体积混合后,溶液中c(H+)<c(OH-) |
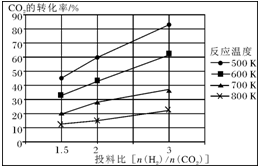 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.