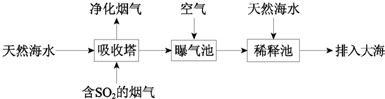
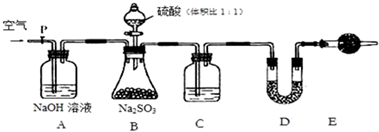
题目内容
下列电离方程式不正确的是( )
| A、Al2 (SO4)3=2Al3++3SO42- |
| B、Ba(OH)2=Ba2++2OH- |
| C、Na2SO4=Na2++SO42- |
| D、NH4NO3=NH4++NO3- |
考点:电离方程式的书写
专题:离子反应专题
分析:强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”,多元弱酸,应分步电离,离子团在电离方程式中不能拆开,据此进行分析解答.
解答:
解:A.硫酸铝为强电解质,完全电离,电离方程式为:Al2 (SO4)3=2Al3++3SO42-,故A正确;
B.氢氧化钡为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,故B正确;
C.硫酸钠为强电解质,完全电离,电离方程式为:Na2SO4=2Na++SO42-,故C错误;
D.硝酸铵为强电解质,完全电离,电离方程式为:NH4NO3=NH4++NO3-,故D正确;
故选:C.
B.氢氧化钡为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,故B正确;
C.硫酸钠为强电解质,完全电离,电离方程式为:Na2SO4=2Na++SO42-,故C错误;
D.硝酸铵为强电解质,完全电离,电离方程式为:NH4NO3=NH4++NO3-,故D正确;
故选:C.
点评:本题考查了电离方程式的书写,明确电解质的强弱和电离方式是解题关键,注意离子符合书写的规范性.

练习册系列答案
相关题目
下列关于1mol/L Na2SO4溶液的说法正确的是( )
| A、将142g Na2SO4溶于少量水后再稀释到 100mL |
| B、1 L溶液中含有142 g Na2SO4 |
| C、1 mol Na2SO4溶于1 L蒸馏水中 |
| D、溶液中含有1molNa+ |
能证明胶体微粒比溶液中电解质微粒大的操作是( )
| A、丁达尔效应 | B、布朗运动 |
| C、渗析 | D、电泳现象 |
下列反应的离子方程式正确的是( )
| A、向含有Hg2+的废水中加入Na2S:Hg2++S2-═HgS |
| B、用碳酸氢钠作为抗酸药来中和胃酸 2H++CO32-═H2O+CO2↑ |
| C、用熟石灰来中和酸性废水 Ca(OH)2+2H+═Ca2++2H2O |
| D、用H2SO4来中和碱性废水 2H++2OH-═H2O |
已知3.01×1023个X气体分子的质量为32g,则X气体的摩尔质量是( )
| A、16g |
| B、32g |
| C、64g/mol |
| D、32g/mol |
当光束通过下列分散系:①稀硫酸 ②雾 ③蒸馏水 ④墨水,能观察到丁达尔效应的有( )
| A、①③ | B、②③ | C、②④ | D、③④ |
下列描述正确的是( )
| A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、可通过溶液导电能力的大小判断强弱电解质 |
| D、在NaHSO4溶液中存在的离子有:Na+、H+、HSO4-、OH- |
某条件下锌与稀硝酸反应时其物质的量之比为5:12,则此时硝酸的还原物是( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2 |