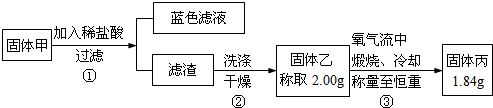
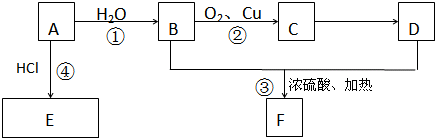
题目内容
某条件下锌与稀硝酸反应时其物质的量之比为5:12,则此时硝酸的还原物是( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2 |
考点:氧化还原反应的计算
专题:
分析:锌与稀硝酸反应时,硝酸既表现酸性又表现氧化性,反应生成Zn(NO3)2与含氮的化合物,假设Zn为5mol,根据Zn守恒可知Zn(NO3)2为5mol,起酸性的硝酸为10mol,假设其余的硝酸全部被还原,根据电子转移守恒计算N元素在还原产物中化合价,据此解答.
解答:
解:锌与稀硝酸反应时,硝酸既表现酸性又表现氧化性,反应生成Zn(NO3)2与含氮化合物,假设Zn为5mol,则参加反应的硝酸为12mol,根据Zn守恒可知Zn(NO3)2为5mol,起酸性的硝酸为10mol,假设其余的硝酸全部被还原,则还原的硝酸为12mol-5mol×2=2mol,设N元素在还原产物中化合价为a,根据电子转移守恒,则:5mol×2=2mol×(5-a),解得a=0,故选D.
点评:本题考查氧化还原反应的有关计算,注意利用电子转移守恒解答,侧重考查学生的分析计算能力,难度中等.

练习册系列答案
相关题目
下列电离方程式不正确的是( )
| A、Al2 (SO4)3=2Al3++3SO42- |
| B、Ba(OH)2=Ba2++2OH- |
| C、Na2SO4=Na2++SO42- |
| D、NH4NO3=NH4++NO3- |
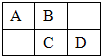 A、B、C、D为短周期元素,在周期表中所处的位置如图所示.A、D两元素的原子核外电子数之和等于B、C两元素的原子核外电子数之和.C元素的质子数是B元素的质子数的2倍.
A、B、C、D为短周期元素,在周期表中所处的位置如图所示.A、D两元素的原子核外电子数之和等于B、C两元素的原子核外电子数之和.C元素的质子数是B元素的质子数的2倍.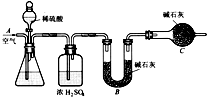
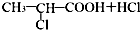
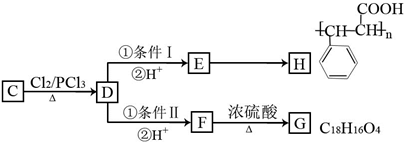
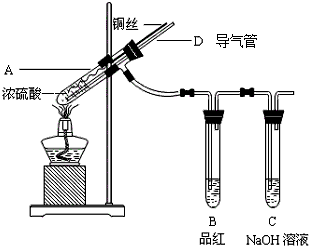 某同学为了探究铜与浓硫酸的反应,进行了如下实验.
某同学为了探究铜与浓硫酸的反应,进行了如下实验.