题目内容
有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子.试回答:
(1)写出各元素符号:X 、Y 、Z .
(2)X离子的结构示意图为 .X与Y形成的离子化合物的电子式为 ,Z和氢形成的化合物的电子式为 .
(3)Y单质在空气中燃烧的化学方程式为 ,生成物与水反应的化学方程式为 .
(1)写出各元素符号:X
(2)X离子的结构示意图为
(3)Y单质在空气中燃烧的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,在该氢化物中,X显-2价,则X为第VIA族元素,且为短周期元素,所以X是O或S元素,此氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17:40,O元素没有氧化物,所以X是S元素,X原子核内质子数与中子数相等,则X是1632S,Y与X可以形成离子化合物Y2X,在该化合物中,Y显+1价,Y是短周期元素,则Y为第IA族元素,Y的阳离子电子层结构与Ne相同,所以Y是Na元素,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子,则Z位于第三周期第VIIA族,为Cl元素,据此解答各小题即可.
解答:
解:X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,在该氢化物中,X显-2价,则X为第VIA族元素,且为短周期元素,所以X是O或S元素,此氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17:40,O元素没有氧化物,所以X是S元素,X原子核内质子数与中子数相等,则X是1632S,Y与X可以形成离子化合物Y2X,在该化合物中,Y显+1价,Y是短周期元素,则Y为第IA族元素,Y的阳离子电子层结构与Ne相同,所以Y是Na元素,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子,则Z位于第三周期第VIIA族,为Cl元素,依据分析可知:X为硫,Y为钠,Z为氯,
(1)通过以上分析知,X、Y、Z分别为硫、钠、氯元素,故答案为:S;Na;Cl;
(2)X是S元素,硫离子核外有18个电子,硫离子的结构示意图为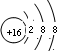 ,化合物Na2S属于离子化合物,硫离子和钠离子之间只含离子键,则硫化钠的电子式为
,化合物Na2S属于离子化合物,硫离子和钠离子之间只含离子键,则硫化钠的电子式为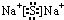 ,Cl和氢形成的化合物为HCl,HCl中H与Cl形成一对共价键,故其电子式为:
,Cl和氢形成的化合物为HCl,HCl中H与Cl形成一对共价键,故其电子式为: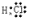 ,故答案为:
,故答案为: ;
;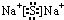 ;
;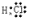 ;
;
(3)Y单质是钠,钠在空气中燃烧生成过氧化钠,反应方程式为:2Na+O2
Na2O2,过氧化钠与水反应生成氢氧化钠与水,反应的化学反应方程式为:2Na2O2+2H2O=4NaOH+O2,故答案为:2Na2O2+2H2O=4NaOH+O2.
(1)通过以上分析知,X、Y、Z分别为硫、钠、氯元素,故答案为:S;Na;Cl;
(2)X是S元素,硫离子核外有18个电子,硫离子的结构示意图为
 ,化合物Na2S属于离子化合物,硫离子和钠离子之间只含离子键,则硫化钠的电子式为
,化合物Na2S属于离子化合物,硫离子和钠离子之间只含离子键,则硫化钠的电子式为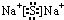 ,Cl和氢形成的化合物为HCl,HCl中H与Cl形成一对共价键,故其电子式为:
,Cl和氢形成的化合物为HCl,HCl中H与Cl形成一对共价键,故其电子式为: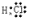 ,故答案为:
,故答案为: ;
;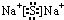 ;
;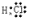 ;
;(3)Y单质是钠,钠在空气中燃烧生成过氧化钠,反应方程式为:2Na+O2
| ||
点评:本题主要考查了电子式、化学反应方程式的书写,正确推断元素是解本题关键,难点是硫化钠电子式的书写.

练习册系列答案
相关题目
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| B、HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
| C、HF、CH3CH2OH、KOH都易溶于水,都是电解质 |
| D、HCOOH、H2CO3、H2S分子中均含有两个氢原子,都是二元酸 |
下列分子或离子在指定的溶液中能大量共存的一组是( )
| A、含0.1mol?L-1 HCO3-的溶液中 NH4+、Na+、ClO-、C2H5OH |
| B、SO2的饱和溶液中,Ba2+,K+,NO3-、Cl- |
| C、c(OH-)/c(H+)=1×10-13的溶液中,K+、Ag+、NO3-、I- |
| D、加入酚酞试液是无色的溶液中,Mg2+、Fe3+、Br-、CH3COOH |
 通过石油裂解可以获得A,再以A为原料还可以合成很多的化工产品.已知F可作为保鲜膜的材料,E是有香味的液体.试根据如图回答有关问题:
通过石油裂解可以获得A,再以A为原料还可以合成很多的化工产品.已知F可作为保鲜膜的材料,E是有香味的液体.试根据如图回答有关问题: