题目内容
下列分子或离子在指定的溶液中能大量共存的一组是( )
| A、含0.1mol?L-1 HCO3-的溶液中 NH4+、Na+、ClO-、C2H5OH |
| B、SO2的饱和溶液中,Ba2+,K+,NO3-、Cl- |
| C、c(OH-)/c(H+)=1×10-13的溶液中,K+、Ag+、NO3-、I- |
| D、加入酚酞试液是无色的溶液中,Mg2+、Fe3+、Br-、CH3COOH |
考点:离子共存问题
专题:
分析:A.发生氧化还原反应的离子不能共存;
B.二氧化硫具有还原性,能被氧化性离子氧化;
C.c(OH-)/c(H+)=1×10-13的溶液呈强酸性,离子之间不反应,且离子和氢离子也不反应;
D.加入酚酞试液是无色的溶液中酸性或中性.
B.二氧化硫具有还原性,能被氧化性离子氧化;
C.c(OH-)/c(H+)=1×10-13的溶液呈强酸性,离子之间不反应,且离子和氢离子也不反应;
D.加入酚酞试液是无色的溶液中酸性或中性.
解答:
解:A.ClO-、C2H5OH发生氧化还原反应,所以不能大量共存,故A错误;
B.酸性条件下,硝酸根离子具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原反应而不能大量共存,故B错误;
C.c(OH-)/c(H+)=1×10-13的溶液呈强酸性,Ag+、I-生成沉淀AgI,且酸性条件下NO3-、I-发生氧化还原反应而不能大量共存,故C错误;
D.加入酚酞试液是无色的溶液中酸性或中性,若为酸性,这几种离子之间都不反应,所以能大量共存,故D正确;
故选D.
B.酸性条件下,硝酸根离子具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原反应而不能大量共存,故B错误;
C.c(OH-)/c(H+)=1×10-13的溶液呈强酸性,Ag+、I-生成沉淀AgI,且酸性条件下NO3-、I-发生氧化还原反应而不能大量共存,故C错误;
D.加入酚酞试液是无色的溶液中酸性或中性,若为酸性,这几种离子之间都不反应,所以能大量共存,故D正确;
故选D.
点评:本题考查离子共存,为高考高频点,明确离子性质及离子反应条件是解本题关键,离子共存常常与复分解反应、络合反应、氧化还原反应、双水解反应、酸碱指示剂、溶液pH等知识点联合考查,题目难度中等.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
将a mL NO,b mL NO2和c mL O2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a:b:c不可能是( )
| A、1:1:1 |
| B、2:1:1 |
| C、3:4:7 |
| D、1:5:2 |
下列几种试剂不能把等物质的量浓度的Na2CO3,NaHCO3鉴别开的是( )
| A、CaCl2溶液 |
| B、澄清石灰水 |
| C、稀盐酸 |
| D、pH试纸 |
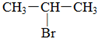 ;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.
;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.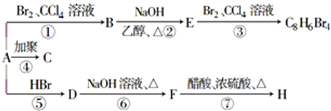
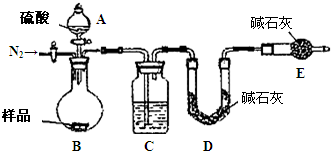 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空: