题目内容
11.在钠和水的反应实验中,你观察不到的现象是( )| A. | 酚酞试液从无色变为红色 | B. | 钠安静地浮在水面上 | ||
| C. | 钠熔化成光亮的小球 | D. | 钠在水面上到处游动 |
分析 钠的密度小于水的密度,钠和水反应生成氢气和氢氧化钠,同时有大量热量放出,据此分析判断.
解答 解:A.钠和水反应生成氢气和氢氧化钠,氢氧化钠的水溶液呈碱性,向氢氧化钠溶液中滴加无色酚酞试液后,溶液呈红色,故A正确;
B.钠的密度小于水的密度,钠和水反应生成氢气,所以钠会浮在水面上到处游动,故B错误;
C.钠的熔点较低,钠和水反应时同时放出大量热,放出的热量导致钠熔成小球,故C正确;
D.钠和水反应生成氢气,所以钠在水面上到处游动,故D正确;
故选B.
点评 本题考查了钠的性质,根据钠的物理性质和化学性质来分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.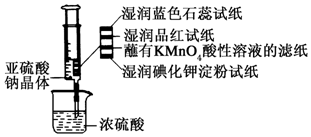 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸只变红不褪色 | |
| B. | 湿润的品红试纸蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2不能将I-还原为I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
19.化学与生活密切相关,下列一些物质的用途或对环境的影响解释错误的是( )
| 选项 | 对环境的影响(或用途) | 解释 |
| A | 酒精用于环境消毒 | 酒精能使蛋白质变性 |
| B | 热碳酸钠溶液清除炊具上残留的油污 | 碳酸钠溶液水解显碱性 |
| C | SO2和NO2溶于水形成酸雨 | SO2和NO2是酸性氧化物 |
| D | 浸泡过酸性KMnO4溶液的硅藻土保鲜水果 | 酸性KMnO4溶液氧化乙烯 |
| A. | A | B. | B | C. | C | D. | D |
16.表是汽车行驶速度与所产生大气污染物的质量之间的关系(按平均行驶lkm计算).要使污染程度最小,汽车的速度应保持多少最为合适( )
| 污染物 | 速度/(km•h-1) | |||
| 50 | 80 | 90 | 120 | |
| 一氧化碳/g | 8.7 | 5.4 | 4.7 | 9.6 |
| 氮的氧化物/g | 0.6 | 1.5 | 1.7 | 3.8 |
| 碳氢化合物/g | 0.7 | 0.6 | 0.5 | 0.8 |
| A. | 50 | B. | 80 | C. | 90 | D. | 120 |
3. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 | |
| B. | 25min时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡大 | |
| C. | 反应开始到第一次平衡时,N2的平均反应速率为0.0625mol•(L•min)-1,H2的转化率为75% | |
| D. | 从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
20.下列溶液中微粒浓度关系正确的是( )
| A. | 室温时,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 0.1 mol•L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| D. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
1.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1.7g的NH3中含有的质子数为0.1NA | |
| B. | 标准状况下,5.6L水含有的分子数为0.25NA | |
| C. | 标准状况下,22.4L氮气和氢气的混合物中所含的分子数为NA | |
| D. | 常温下,9.5克MgCl2中含Mg2+ 为0.2 NA |
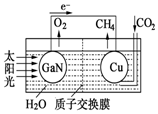 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.