题目内容
1.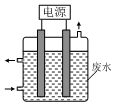 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 用石墨作阳极,铁作阴极 |
分析 A.ClO-将CN-氧化为两种无污染的气体,这两种无污染的气体分别为N2、CO2,同时次氯酸根两种被还原生成氯离子,溶液呈碱性,该反应中应该有OH-生成;
B.阳极上Cl-失电子和水反应生成ClO-和H2O;
C.阴极上水得电子生成氢气;
D.阳极上Cl-放电,所以电极材料应该是惰性电极材料.
解答 解:A.ClO-将CN-氧化为两种无污染的气体,这两种无污染的气体分别为N2、CO2,同时次氯酸根两种被还原生成氯离子,溶液呈碱性,该反应中应该有OH-生成,离子方程式为:2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故A错误;
B.阳极上Cl-失电子和水反应生成ClO-和H2O,电极反应式为Cl-+2OH--2e-═ClO-+H2O,故B正确;
C.阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,故C正确;
D.阳极上Cl-放电,所以电极材料应该是惰性电极材料,所以用石墨作阳极,可以用Fe作阴极,故D正确;
故选A.
点评 本题考查电解原理,为高频考点,侧重考查学生获取信息、分析判断信息能力,明确离子放电顺序及电解原理是解本题关键,注意:碱性条件下电极反应式中氢离子不能参加反应或生成氢离子,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.已知X+Y→M+N反应中的能量变化过程如图,则下列推断一定正确的是( )

| A. | X的能量低于M的能量 | |
| B. | Y的能量低于N的能量 | |
| C. | X和Y总能量低于M和N总能量 | |
| D. | 该反应是吸热反应,反应条件是加热 |
12.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物 质 | 试 剂 | 分 离 方 法 | |
| A. | Cl2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
| B. | 硬脂酸钠(甘油) | 饱和食盐水 | 盐析后过滤 |
| C. | KNO3(KCl) | 水 | 蒸发结晶 |
| D. | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
16.现有部分元素的性质、用途与原子(或分子)结构如表所示:
(1)元素Y在周期表中的位置第二周期ⅡA族,元素T的简单离子结构示意图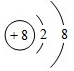 .
.
(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
.
(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 $\frac{\underline{\;\;△\;\;}}{\;}$ 丙+丁,该反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| W | 周期表中原子半径最小的元素 |
| X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | M层比K层少1个电子 |
| T | 存在两种同素异形体,其中一种可吸收紫外线 |
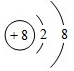 .
.(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
 .
.(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 $\frac{\underline{\;\;△\;\;}}{\;}$ 丙+丁,该反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O.
6.下列由实验现象得出的结论正确的是( )
| 选项 | 实验及现象 | 结论 |
| A | 向AgNO3和AgCl的浊液中滴入0.1mol/LNa2S溶液,生成黑色沉淀 | Ag2S的溶度积比AgCl的小 |
| B | 将光亮镁条放入盛有NH4Cl溶液的试管中,产生大量气泡,同时将湿润的红色石蕊试纸靠近试管口,试纸变蓝 | 反应产生的气体一定是NH3 |
| C | 向溶液X中先滴加稀硝酸,在滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中,溶液变蓝 | 说明氧化性Fe3+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
13.化合物X是一种医药中间体,其结构简式如图所示.下列有关X的说法正确的是( )
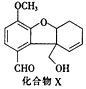

| A. | 分子中含2个手性碳原子 | |
| B. | 分子中所有碳原子均处于同一平面 | |
| C. | 能发生银镜反应,不能发生酯化反应 | |
| D. | 1molX最多能与4molH2发生加成反应 |
10.已知常温下0.1mol/L NaHSO3溶液pH<7,将10mL 0.1mol/LBa(OH)2溶液缓慢滴加到10mL 0.1mol/L NaHSO3溶液中,下列说法不正确的是( )
| A. | 常温下0.1 mol/L NaHSO3溶液中HSO3-电离程度大于水解程度 | |
| B. | 当加入的Ba(OH)2溶液体积小于5 mL时,溶液中的反应为:2HSO3-+Ba2++2OH-?BaSO3↓+2H2O+SO32- | |
| C. | 滴加过程中,溶液中白色沉淀不断增加 | |
| D. | 当加入Ba(OH)2溶液体积为7.5 mL时,溶液中离子浓度大小为:c(Na+)>c(SO32-)>c(OH-)>c(H+) |
11.下列离子方程式与所述事实相符且正确的是( )
| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液去油污:CO32-+H2O═HCO3-+OH- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+AlO2-+2H2O |
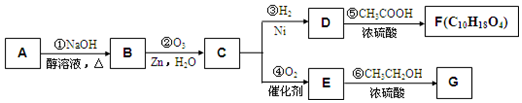
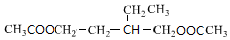 ,E
,E .
.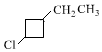 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$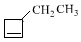 +NaBr+H2O,C→D
+NaBr+H2O,C→D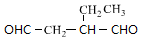 +2H2$\stackrel{催化剂}{→}$
+2H2$\stackrel{催化剂}{→}$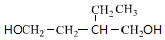 .
.