题目内容
11.下列离子方程式与所述事实相符且正确的是( )| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液去油污:CO32-+H2O═HCO3-+OH- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+AlO2-+2H2O |
分析 A.钠与水反应生成氢氧化钠和氢气;
B.碳酸根离子的水解为可逆反应,应该用可逆号;
C.反应生成二氧化硫气体和硫单质;
D.氢氧化钡过量,铝离子和硫酸根离子都完全反应,铝离子与硫酸根离子的物质的量之比应该为1:2.
解答 解:A.钠与水反应生成NaOH和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.纯碱为碳酸钠,碳酸根离子水解溶液呈碱性,可以去油污,正确的离子方程式为:CO32-+H2O?HCO3-+OH-,故B错误;
C.Na2S2O3溶液中加入稀硫酸,反应生成硫酸钠、二氧化硫气体、S单质和水,正确的离子方程式为:S2O32-+2H+═SO2↑+S↓+H2O,故C错误;
D.明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选A.
点评 本题考查了离子方程式的判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
1.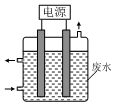 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 用石墨作阳极,铁作阴极 |
2.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属:S>C |
| B | 向雨水中加入少量硫酸铁 | 容器底部出现不溶物 | 铁盐具有杀菌作用 |
| C | 向蔗糖中加入浓H2SO4 | 蔗糖变黑,并放出有刺激性气味的气体 | 浓H2SO4具有脱水性 |
| D | 有色布条放入盛满干燥的Cl2的集气瓶中,盖上玻璃片 | 布条不褪色 | 干燥的Cl2不能漂白 |
| A. | A | B. | B | C. | C | D. | D |
19.下列说法正确的是( )
| A. | 实验室中将钠保存于煤油或石蜡油中 | |
| B. | 金属镁着火使用泡沫灭火器灭火 | |
| C. | 用湿润的淀粉-KI试纸鉴别NO2和溴蒸气 | |
| D. | 配制一定物质的量浓度的溶液时,向容量瓶中倒入液体至刻度线 |
6.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 在12.0g NaHSO4晶体中,所含离子数目为0.3NA | |
| B. | 在1.0L 1.0mol/L的NaA1O2溶液中,含有的氧原子数为2NA | |
| C. | 将1molCl2通入足量水中,转移电子数为NA | |
| D. | 常温常压下,2.2gC O2和N2O的混合气体含有的电子数为1.1NA |
16.W、X、Y、Z为原子序数依次增大的短周期元素,X、Y、Z同周期且相邻.由上述四种元素组成的化合物分解生成三种产物,其中两种气体产物的水溶液酸碱性相反.下列说法正确的是( )
| A. | 原子半径:W<X<Y<Z | |
| B. | 最高价氧化物对应水化物酸性:X>Y | |
| C. | W、X两种元素组成的化合物难溶于水 | |
| D. | W、Y、Z三种元素不能组成离子化合物 |
4.下列叙述正确的是( )
| A. | △H>0的反应,升高温度v正增大,v逆减小,平衡向正反应方向移动 | |
| B. | 若化学平衡移动了,但正、逆反应不一定都变化 | |
| C. | 正、逆反应速率都变化了,化学平衡必发生移动 | |
| D. | 石墨吸收能量后可转化为金刚石,说明金刚石比石墨稳定 |
5.某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
[猜想假设]黑色粉末X的组成可能是Fe、Fe3O4,或二者的混合物.
[实验探究]
(1)实验①中产生气泡的离子方程式为Fe+2H+═Fe2++H2↑.
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+.
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如图所示实验:

请根据数据分析说明黑色粉末X中是否含有Fe3O4.方法1:因为32gFe2O3中含Fe元素为22.4g,而25.6g>22.4g,所以X中还含有O元素,还含有Fe3O4;
方法2:因为产生产生4.48L氢气,需要Fe单质为11.2g,而25.6g>11.2g,所以X中还含有Fe3O4.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
[猜想假设]黑色粉末X的组成可能是Fe、Fe3O4,或二者的混合物.
[实验探究]
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
| ② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+.
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如图所示实验:

请根据数据分析说明黑色粉末X中是否含有Fe3O4.方法1:因为32gFe2O3中含Fe元素为22.4g,而25.6g>22.4g,所以X中还含有O元素,还含有Fe3O4;
方法2:因为产生产生4.48L氢气,需要Fe单质为11.2g,而25.6g>11.2g,所以X中还含有Fe3O4.