题目内容
12.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )| 物 质 | 试 剂 | 分 离 方 法 | |
| A. | Cl2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
| B. | 硬脂酸钠(甘油) | 饱和食盐水 | 盐析后过滤 |
| C. | KNO3(KCl) | 水 | 蒸发结晶 |
| D. | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者都与饱和碳酸氢钠溶液反应生成二氧化碳气体;
B.硬脂酸钠在盐溶液中的溶解度较小;
C.应用重结晶的方法分离;
D.二者都与氢氧化钠溶液反应.
解答 解:A.氯气和水反应生成盐酸和次氯酸,都与饱和碳酸氢钠溶液反应生成二氧化碳气体,应用饱和食盐水除杂,故A错误;
B.硬脂酸钠在盐溶液中的溶解度较小,可用盐析的方法分离,故B正确;
C.硝酸钾、氯化钾都溶于水,但二者的溶解度随温度的变化不同,应用重结晶的方法分离,故C错误;
D.二者都与氢氧化钠溶液反应,应用饱和碳酸钠溶液除杂,故D错误.
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
1.如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )


| A. | 卤素单质(X2)与水反应均可生成两种酸 | |
| B. | 用电子式表示MgF2的形成过程为: | |
| C. | 热稳定性:MgI2>MgBr2>MgCl2>MgF2 | |
| D. | 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)═MgCl2(s)+I2(g),△H=-277kJ•mol-1 |
3.下列条件变化,一定使任何反应的正、逆反应速率都增大的是( )
| A. | 缩小反应容器的体积 | B. | 增加反应物的物质的量 | ||
| C. | 升高温度 | D. | 增加催化剂的用量 |
7.一个原电池的总反应方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是( )
| A | B | C | D | |
| 正极 | Zn | Ag | Cu | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | FeCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
17.某pH=1的X溶液中可能含有Fe2+、Mg2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程(加热不用标出)及产物如图:
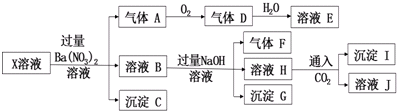
下列说法正确的是( )

下列说法正确的是( )
| A. | 气体A是无色有刺激性气味的有毒气体 | |
| B. | X中肯定存在Fe2+、Mg2+、NH4+、SO42- | |
| C. | 沉淀I中加入过量溶液E,沉淀完全溶解 | |
| D. | X中不能确定的阳离子只有A13+ |
1.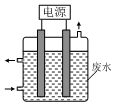 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 用石墨作阳极,铁作阴极 |
2.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属:S>C |
| B | 向雨水中加入少量硫酸铁 | 容器底部出现不溶物 | 铁盐具有杀菌作用 |
| C | 向蔗糖中加入浓H2SO4 | 蔗糖变黑,并放出有刺激性气味的气体 | 浓H2SO4具有脱水性 |
| D | 有色布条放入盛满干燥的Cl2的集气瓶中,盖上玻璃片 | 布条不褪色 | 干燥的Cl2不能漂白 |
| A. | A | B. | B | C. | C | D. | D |
 、
、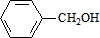 .
.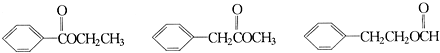
 、
、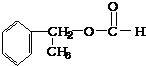 .
. A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,C、D同一主族,D元素原子M层有一对成对的p电子,元素E位于周期表ⅠB族.请回答下列相关问题(涉及元素的请用对应的元素符号冋答)
A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,C、D同一主族,D元素原子M层有一对成对的p电子,元素E位于周期表ⅠB族.请回答下列相关问题(涉及元素的请用对应的元素符号冋答)