题目内容
5.二氧化锰是常用的催化剂、氧化剂和活性电极材料.海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示: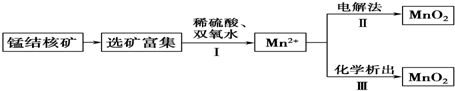
已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰.下列推断不正确的是( )
| A. | 反应Ⅰ的离子方程式为MnO2+H2O2+2H+═Mn2++2H2O+O2↑ | |
| B. | 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O═MnO2↓+4H+ | |
| C. | 若加入KClO3,则反应Ⅲ为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+ | |
| D. | 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+ |
分析 A.双氧水具有还原性,二氧化锰具有氧化性,二者在酸性环境下发生氧化还原反应;
B.在电解池的阴极上发生得电子的还原反应;
C.根据流程图的转化,结合氧化还原理论即可写出离子方程式;
D.KMnO4具有强氧化性,结合流程图的转化,根据氧化还原理论即可写出离子方程式.
解答 解:A.双氧水具有还原性,在酸性环境下,得到的氧化产物是氧气,二氧化锰具有氧化性,在酸性环境下,得到还原产物是锰离子,二者在酸性环境下发生氧化还原反应,反应的离子方程式为:MnO2+2H++H2O2═Mn2++O2↑+2H2O,故A正确;
B.在电解池的阴极上发生得电子的还原反应,Mn2+-2e-+2H2O═MnO2↓+4H+为失电子的氧化反应在阳极上发生,故B错误;
C.根据流程图的转化,结合氧化还原理论即可写出离子方程式为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+,故C正确;
D.KMnO4具有强氧化性,结合流程图的转化,根据氧化还原理论反应Ⅲ为Mn2+与MnO4发生归中反应,即反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+,故D正确;
故选B.
点评 本题考查氧化还原反应方程式及电解池电极反应式的书写,解答本题时要充分理解图中提供的信息,理解了图中信息能对问题做出正确的判断,题目难度不大.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
15.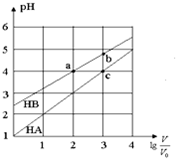 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| C. | 溶液中水的电离程度:a=c>b | |
| D. | 当$lg\frac{V}{V_0}=3$时,若两溶液同时升高温度,则$\frac{{c({B^-})}}{{c({A^-})}}$减小 |
10.下列叙述中,正确的是( )
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程中镀层金属应该放在阳极.
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程中镀层金属应该放在阳极.
| A. | ①②③④ | B. | ③④ | C. | ③④⑤ | D. | ④ |
17.为了检验和除去表中的各种杂质(括号里的物质为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
①检验的试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
③写出除杂时,乙烯发生反应的化学方程式:CH2=CH2+Br2→BrCH2CH2Br.
| 物 质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | B | d |
| 酒 精(水) | A | c |
A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
③写出除杂时,乙烯发生反应的化学方程式:CH2=CH2+Br2→BrCH2CH2Br.
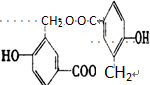
14.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 分子式为C13H18Cl | |
| B. | 能使酸性KMnO4溶液褪色,但不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 含有两种官能团 |
15.以下说法正确的是( )
| A. | 物质中化学键破坏了,一定发生了化学变化 | |
| B. | 水的沸点比硫化氢高,是因为水中的化学键比硫化氢中的化学键强 | |
| C. | 第三周期元素的离子半径逐渐变小 | |
| D. | 共价化合物中一定存在化学键 |
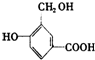 的结构回答下列问题:
的结构回答下列问题: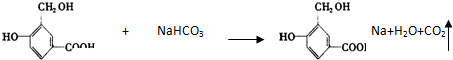
 .
.