题目内容
14.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 分子式为C13H18Cl | |
| B. | 能使酸性KMnO4溶液褪色,但不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 含有两种官能团 |
分析 该有机物中含苯环、碳碳双键、-Cl,结合烯烃、卤代烃的性质来解答.
解答 解:A.由结构简式可知分子式为C13H17Cl,故A错误;
B.含碳碳双键,能使溴水褪色,故B错误;
C.苯环和碳碳双键均可与氢气发生加成反应,则在加热和催化剂作用下,最多能和4 mol H2反应,故C错误;
D.由结构简式可知碳碳双键、-Cl,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,注意把握官能团与性质的关系为解答的关键,熟悉烯烃、卤代烃的性质即可解答,题目难度不大.

练习册系列答案
相关题目
4.一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)?C0Cl2(g),其中容器I中5min时到达平衡.下列说法中正确的是( )
| 温度/℃ | 起始物成质的量/mol | 平衡物质的两/mol | |||
| 容器编马 | CO | Cl2 | COCl2 | COCl2 | |
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 07 |
| A. | 容器I中前5min的平均反应速率v(CO)=0.16mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55mol | |
| D. | 若起始时向容器I加入CO0.8mol,Cl20.8mol,达到平衡时CO转化率大于80%. |
5.二氧化锰是常用的催化剂、氧化剂和活性电极材料.海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:
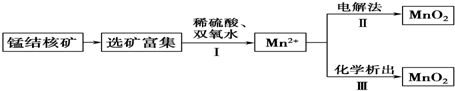
已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰.下列推断不正确的是( )

已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰.下列推断不正确的是( )
| A. | 反应Ⅰ的离子方程式为MnO2+H2O2+2H+═Mn2++2H2O+O2↑ | |
| B. | 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O═MnO2↓+4H+ | |
| C. | 若加入KClO3,则反应Ⅲ为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+ | |
| D. | 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+ |
2.某有机物的结构如图所示,它不可能具有的性质是( )


| A. | 能跟NaOH溶液反应 | B. | 能使酸性KMnO4溶液褪色 | ||
| C. | 呈碱性 | D. | 能发生酯化反应 |
9.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L的戊烷所含的分子数为0.5NA | |
| B. | 0.5mol C3H8分子中含C-H共价键2NA | |
| C. | 11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
6.下列说法正确的是( )
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫牺牲阳极的阴极保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
3.下列有关说法中错误的是( )
| A. | CCl4可以由CH4制得,它可用于萃取碘水中的碘 | |
| B. | 相等的物质的量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| C. | 用乙烯与HCl反应来制备氯乙烷比用乙烷与氯气反应更好 | |
| D. | 甲烷的空间构型是正四面体,所以二氯甲烷有两种不同的结构 |